Неорганические соединения представляют собой неорганические вещества, которые включают в себя широкий спектр элементов, таких как металлы, неметаллы и полуметаллы. Такие соединения играют важную роль не только в химической промышленности, но и в нашей повседневной жизни. Классификация неорганических соединений в таблице помогает нам ориентироваться в этом разнообразии и понимать их основные свойства и характеристики.
Таблица классификации неорганических соединений включает в себя четыре основных категории: оксиды, кислоты, основания и соли. Каждая из этих категорий имеет свои специфические химические свойства и выражается в различных реакциях и взаимодействиях с другими веществами.
Оксиды – это неорганические соединения, состоящие из химической связи между элементом и кислородом. Они являются основными компонентами большинства неорганических веществ. Оксиды могут быть кислотными (когда они реагируют с водой, образуя кислоты) или основными (когда они реагируют с водой, образуя основания).
Кислоты представляют собой соединения, которые способны отделять водородные ионы (H+) в растворах. Они являются основными источниками водорода для различных химических реакций. Кислоты могут быть органическими или неорганическими, и они играют важную роль во многих процессах, таких как пищеварение и растворение металлов.
Основания – это соединения, которые способны отделять гидроксильные ионы (OH-) в растворах. Они являются щелочными веществами и обладают свойствами нейтрализации кислотных растворов. Основания могут быть как неорганическими, так и органическими, и они играют важную роль в таких процессах, как нейтрализация, гидролиз и обмен ионами.
Соли – это соединения, получаемые в результате реакции кислоты и основания. Они обладают ионным составом и образуются при обмене ионами в процессе нейтрализации. Соли могут быть как растворимыми, так и нерастворимыми в воде, и они играют важную роль в различных отраслях промышленности, медицине и пищевой промышленности.
Таким образом, классификация неорганических соединений в таблице помогает нам систематизировать их и разобраться в их химических свойствах. Это основа для дальнейшего изучения и применения неорганической химии в различных областях науки и техники.
- Значение классификации неорганических соединений
- Основные принципы классификации
- Основные группы неорганических соединений
- Группировка по элементам
- Структурные характеристики соединений
- Важность таблицы классификации
- Удобство систематизации знаний
- Помощь в обучении химии
- Основные типы неорганических соединений
- Соли
- Кислоты
- Оксиды
- Гидроксиды
- Соединения элементов группы 14 и 15
- Комплексные соединения
- 📹 Видео
Видео:Классификация неорганических веществСкачать

Значение классификации неорганических соединений
Классификация неорганических соединений имеет важное значение в науке и практическом применении. Она позволяет систематизировать и упорядочить огромное количество различных соединений, что облегчает изучение их свойств, структуры и реакций.
Классификация неорганических соединений также имеет практическое значение. Она помогает упростить процесс определения и номенклатуры соединений, что особенно важно при проведении химических исследований, разработке новых материалов и лекарственных препаратов, а также в промышленности.
Кроме того, классификация неорганических соединений позволяет упорядочить данные о свойствах соединений и прогнозировать их реакционную активность. Это позволяет исследователям и инженерам оптимизировать процессы синтеза и использования неорганических соединений для достижения желаемых результатов.
Таким образом, классификация неорганических соединений является важным инструментом в научных и практических исследованиях, который помогает систематизировать и упорядочить информацию о соединениях, а также предсказывать их свойства и реакционную активность. Это позволяет упростить изучение неорганических соединений и применять их с максимальной эффективностью в различных областях науки и техники.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Основные принципы классификации
Для удобства и систематизации неорганических соединений разработаны основные принципы и методы их классификации. Классификация основывается на химическом составе, строении и свойствах соединений.
Один из основных принципов классификации основан на строении соединений и разделении их на следующие группы:
| Катионы | положительно заряженные частицы, обычно металлы |
| Анионы | отрицательно заряженные частицы, обычно неметаллы |
| Неорганические кислоты | содержат водород и отрицательные элементы |
| Основания | содержат гидроксидные и металлические ионы |
| Соли | образованы замещением гидроксидной группы одного из компонентов вещества |
| Координационные соединения | содержат координационные связи между металлическим и не металлическим атомами |
Другой принцип классификации построен на основе химического состава неорганических соединений:
Оксиды, гидроксиды, карбонаты, нитраты, фосфаты, сульфаты, хлориды, бромиды, йодиды и прочие.
Классификация неорганических соединений позволяет систематизировать их свойства и использовать эти знания в технике, медицине и других сферах деятельности.
Основные группы неорганических соединений
Неорганические соединения представляют собой химические соединения, в которых атомы неорганических элементов образуют различные связи. Все неорганические соединения можно классифицировать на несколько основных групп:
- Оксиды: состоят из атомов кислорода, соединённых с атомами других элементов. Оксиды могут быть кислотными, основными, нейтральными или амфотерными.
- Кислоты: это соединения, которые образуются при реакции оксидов с водой. Кислоты обладают кислой реакцией и могут выделяться водородные ионы.
- Основания: соединения, взаимодействующие с кислотами и образующие с ними соли. Они обладают щелочной реакцией и выделяются гидроксильными ионами.
- Соли: образуются при взаимодействии кислот с основаниями. Соли обладают ионной связью, а их кристаллическая решётка обычно состоит из катионов и анионов.
- Комплексные соединения: это соединения, в которых центральный металл-лиганд образует координационную связь с координатом окоординированным лигандом.
- Галогениды: соединения, состоящие из атомов галогенов и атомов других элементов.
- Карбиды: это бинарные соединения углерода с другим элементом.
- Нитриды: соединения, состоящие из атомов азота и атомов других элементов.
Каждая из этих групп неорганических соединений имеет свои особенности и свойства, которые определяют их применение в различных областях науки и техники.
Группировка по элементам
Неорганические соединения могут быть классифицированы по элементам, которые они содержат. Различные элементы могут образовывать соединения с разными свойствами и химическими реакциями.
Соединения могут быть разделены на группы в зависимости от наличия определенного элемента или его химических свойств. Некоторые группы соединений, которые можно выделить, включают:
Кислоты:
Кислоты — это соединения, которые образуются при растворении в воде и обладают кислотными свойствами. Некоторые общие примеры кислот включают серную кислоту (H2SO4) и соляную кислоту (HCl).
Основания:
Основания — это соединения, которые образуются при растворении в воде и обладают щелочными свойствами. Они часто используются в качестве реагентов или добавок для изменения pH растворов. Примеры оснований включают гидроксид натрия (NaOH) и гидроксид калия (KOH).
Соли:
Соли — это соединения, которые образуются при реакции кислот и оснований. Они обычно обладают кристаллической структурой и хорошо растворяются в воде. Примеры солей включают хлорид натрия (NaCl) и сульфат магния (MgSO4).
Группировка соединений по элементам позволяет упростить их классификацию и понимание их свойств. Она также может быть полезной при изучении реакций и взаимодействий между различными неорганическими соединениями.
Структурные характеристики соединений
Одним из основных параметров, определяющих структурные характеристики соединений, является валентность атомов. Валентность указывает на количество связей, которые данный атом способен образовать с другими атомами. Например, атом кислорода имеет валентность 2, поэтому он может образовывать две связи с другими атомами. Валентность атомов определяет тип связей в молекуле и может быть использована для классификации соединений.
Другим важным параметром структурных характеристик является геометрия молекулы или кристаллической решетки. Геометрия определяется углами и расстояниями между атомами или ионами и может быть разной для различных соединений. Например, молекула воды имеет угловую геометрию, в то время как молекула метана имеет тетраэдрическую геометрию. Геометрия молекулы влияет на ее полюсность, способность образовывать водородные связи и другие химические свойства.
Еще одним важным аспектом структурных характеристик соединений является организация ионной или ковалентной связи. Соединения могут быть ионными, когда атомы образуют положительные и отрицательные ионы и притягиваются друг к другу электростатическими силами, или ковалентными, когда атомы образуют совместно используемые электроны и образуют молекулы. Организация связи определяет химическую стабильность и реакционную активность соединений.
Структурные характеристики соединений играют ключевую роль в их понимании и использовании в различных областях химии и материаловедения. Они помогают установить связь между композицией и свойствами вещества и могут быть использованы для разработки новых материалов с заданными химическими и физическими свойствами.
| Структурная характеристика | Описание |
|---|---|
| Валентность | Количество связей, которые атом способен образовать с другими атомами |
| Геометрия | Углы и расстояния между атомами или ионами в молекуле или кристаллической решетке |
| Организация связи | Ионная или ковалентная связь в соединении |
Видео:Классификация неорганических веществ для ОГЭСкачать

Важность таблицы классификации
Во-первых, таблица классификации помогает установить логическую связь между различными группами соединений, позволяя увидеть их общие черты и различия. Такая систематизация позволяет упростить и ускорить процесс изучения и понимания химических соединений.
Во-вторых, таблица классификации позволяет предсказывать свойства и реакции соединений на основе их положения в классификации. Это помогает химикам понять, какие соединения будут взаимодействовать между собой, а какие нет, и прогнозировать результаты химических экспериментов.
Также таблица классификации позволяет систематизировать и организовать данные об уже известных соединениях, делая информацию более доступной и удобной для использования в научных исследованиях и разработке новых материалов и технологий.
В целом, таблица классификации неорганических соединений играет ключевую роль в области химии, облегчая и ускоряя процесс изучения, понимания и использования химических соединений.
Удобство систематизации знаний
Систематизация знаний важна для эффективного обучения и понимания сложных концепций. В контексте классификации неорганических соединений, таблица становится незаменимым инструментом, позволяющим организовать информацию и упорядочить ее на основе общих свойств и характеристик веществ.
С помощью таблицы можно легко определить классификацию соединений по различным параметрам, таким как состав, степень окисления или тип связи между атомами. Каждая строка и столбец таблицы представляют определенную группу или характеристику, что позволяет быстро находить информацию и проводить сравнение между различными соединениями.
Важно отметить, что систематизация знаний не только облегчает запоминание и организацию информации, но и способствует развитию аналитического мышления и способности видеть связи и закономерности между концепциями. Таблицы, в таком случае, становятся мощным инструментом для анализа и синтеза знаний, позволяя прояснить сложности и увидеть общие тренды.
Использование систематизации знаний в таблице при изучении классификации неорганических соединений имеет ряд преимуществ. Во-первых, это позволяет сохранить структуру информации и представить ее в компактной и удобной форме. Такой подход способствует легкому доступу к информации и ускоряет процесс поиска нужных данных.
Во-вторых, таблица обеспечивает систематизацию знаний, делая их более организованными и логичными. Вся информация располагается в одном месте, что позволяет быстро находить необходимые данные и проводить сравнения между соединениями.
Наконец, таблица является наглядным и понятным способом представления информации. Она позволяет визуализировать связи, закономерности и особенности между соединениями, делая процесс изучения более эффективным и интересным.
Таким образом, систематизация знаний в таблице является эффективным и удобным инструментом при изучении классификации неорганических соединений. Она облегчает запоминание информации, способствует развитию аналитического мышления и позволяет видеть общие тренды и закономерности.
Помощь в обучении химии
На нашем сайте вы найдете подробные материалы по различным темам химии, которые помогут вам понять и запомнить основные понятия и законы.
Мы предлагаем легко воспринимаемые объяснения, примеры и задачи для практического применения знаний. Наши учебники и статьи содержат всю необходимую информацию, чтобы успешно справиться с домашней работой, подготовиться к тестам и экзаменам, а также расширить свои знания.
Если у вас возникли вопросы, не стесняйтесь обращаться к нам. Наша команда опытных преподавателей и химиков готова помочь вам разобраться с любыми сложностями.
Изучение химии может быть увлекательным и интересным процессом, особенно если вы понимаете основы и имеете доступ к качественным материалам. Мы постарались создать для вас такие материалы, которые помогут вам полюбить и успешно освоить эту науку.
Не откладывайте свое обучение на потом, начните сейчас! Мы уверены, что с нашей помощью вы станете настоящим экспертом в химии!
Видео:Классы НЕОРГАНИЧЕСКИХ соединений | Как давать НАЗВАНИЯ ВЕЩЕСТВАМ в химииСкачать

Основные типы неорганических соединений
Существуют несколько основных типов неорганических соединений:
| Тип соединения | Примеры |
|---|---|
| Оксиды | Вода (H2O), диоксид углерода (CO2), оксид алюминия (Al2O3) |
| Соли | Хлорид натрия (NaCl), сульфат магния (MgSO4), нитрат аммония (NH4NO3) |
| Карбонаты | Карбонат кальция (CaCO3), карбонат натрия (Na2CO3), карбонат магния (MgCO3) |
| Нитриды | Нитрид кремния (Si3N4), нитрид бора (BN), нитрид алюминия (AlN) |
| Сульфиды | Сульфид железа (FeS), сульфид цинка (ZnS), сульфид кадмия (CdS) |
Оксиды – это соединения, в которых кислород связан с другими элементами. Соли образуются путем связывания ионов металла и ионов неметалла. Карбонаты включают в себя ионные соединения, содержащие карбонатные ионные группы. Нитриды – это двухатомные или трехатомные молекулы, включающие атомы азота и других элементов. Сульфиды содержат атомы серы и другие элементы.
Классификация неорганических соединений позволяет более точно определить и классифицировать различные химические соединения, учитывая их структуру, свойства и состав. Знание основных типов неорганических соединений является важным для изучения химии и понимания многих химических процессов.
Соли
Соли имеют множество применений в различных отраслях, таких как медицина, пищевая промышленность, химическая промышленность и другие. Некоторые соли используются в качестве добавок в пищу для улучшения вкуса и сохранения продуктов. Другие соли используются в процессе производства стекла, керамики и других материалов.
Соли могут быть классифицированы по различным критериям, таким как состав, структура, способ получения и свойства. Например, соли могут быть однобазными или многобазными в зависимости от того, сколько замещаемых водородных атомов имеют анионы. Они также могут быть классифицированы как кислые, основные или нейтральные в зависимости от их взаимодействия с кислотами или щелочами.
Примеры солей:
— Хлорид натрия (NaCl) — используется в качестве пищевой добавки и дезинфицирующего средства.
— Сульфат меди (II) (CuSO4) — используется в сельском хозяйстве в качестве удобрения и в медицине.
— Карбонат кальция (CaCO3) — используется в производстве стекла, цемента и керамики.
— Нитрат калия (KNO3) — используется в пищевой промышленности в качестве консерванта и удобрения.
Кислоты
Кислоты представляют собой группу неорганических соединений, состоящих из водорода и одного или нескольких элементов из группы неметаллов. Они обладают кислотными свойствами и могут растворяться в воде, образуя водные растворы с характерной кислотной реакцией.
Кислоты могут быть разделены на две основные группы: сильные и слабые кислоты. Сильные кислоты, такие как серная кислота (H2SO4) и хлороводородная кислота (HCl), обладают высокой степенью диссоциации в водных растворах и образуют ионы водорода (H+) и соответствующие анионы. Слабые кислоты, например, уксусная кислота (CH3COOH) и угольная кислота (H2CO3), имеют низкую степень диссоциации и образуют лишь небольшое количество ионов водорода в водном растворе.
Кислоты широко используются в различных отраслях промышленности и науке. Они служат как важные составляющие в производстве пластмасс, удобрений, лекарств и косметических средств, так и в химическом анализе и лабораторных исследованиях. Кислоты также играют важную роль в жизнедеятельности организмов, например, в пищеварении и обмене веществ.
Примеры некоторых основных кислот:
- Серная кислота (H2SO4)
- Соляная кислота (HCl)
- Азотная кислота (HNO3)
- Уксусная кислота (CH3COOH)
- Фосфорная кислота (H3PO4)
Кислоты имеют важное значение в химии и являются одной из основных групп неорганических соединений.
Оксиды
Оксиды обычно имеют вид твёрдых кристаллических веществ, но также могут быть газообразными или жидкими. Они обладают разными свойствами, такими как кислотность, щелочность или нейтральность.
Оксиды подразделяются на несколько видов:
- Металлические оксиды — образуются при соединении металлов с кислородом. Они обычно имеют щелочные свойства и могут растворяться в воде, образуя щелочные растворы.
- Неметаллические оксиды — образуются при соединении неметаллов с кислородом. Они обладают кислотными свойствами и могут растворяться в воде, образуя кислотные растворы.
- Амфотерные оксиды — обладают как щелочными, так и кислотными свойствами. Они могут растворяться как в кислотах, так и в щелочах.
- Перекиси — это оксиды, содержащие промежуточное количество кислорода. Они могут быть использованы, как окислители или средства сохранения кислорода.
Оксиды широко применяются в различных областях, таких как производство стекла, керамика, электроника, металлургия и другие.
Гидроксиды
Гидроксиды являются основаниями и часто используются в химической промышленности, медицине и быту. Некоторые известные гидроксиды включают гидроксид натрия (NaOH), гидроксид калия (KOH) и гидроксид кальция (Ca(OH)2).
Гидроксиды обладают щелочными свойствами и образуют гидроксидные ионы в растворе. Эти ионы способны принимать протоны от кислотных соединений и образовывать соль и воду. Гидроксиды также могут реагировать с кислородом, аммиаком и другими веществами.
Гидроксиды находят применение во многих областях, включая производство мыла, обработку металлов, очистку воды и производство лекарств. Они также используются в качестве основания при проведении химических реакций.
Соединения элементов группы 14 и 15
Группа 14:
К группе 14 принадлежат такие элементы, как углерод, кремний, германий и олово. Соединения этих элементов обладают разнообразными свойствами и применяются в различных областях химии и техники.
Углерод является основой органической химии и образует множество соединений с другими элементами. Одним из наиболее известных и широко применяемых соединений углерода является диоксид углерода (CO2). Он является основным компонентом атмосферного воздуха и применяется в процессе фотосинтеза растений.
Кремний – это элемент, широко распространенный в земной коре. Он образует множество соединений, но наиболее известными из них являются оксиды кремния. Один из таких оксидов – диоксид кремния (SiO2), или кварц, является одним из самых распространенных минералов на Земле и используется в производстве стекла, керамики и других материалов.
Германий, хоть и менее распространенный, также образует множество соединений. Например, оксид германия (GeO2) может использоваться в производстве оптических материалов и полупроводников.
Олово, также как и германий, образует много соединений. Одним из известных соединений олова является оксид олова (SnO2), который применяется в производстве стекла, электронных компонентов и керамики.
Группа 15:
В группе 15 находятся такие элементы, как азот, фосфор, мышьяк и антимон. Соединения этих элементов также обладают разнообразными свойствами и широко применяются в различных отраслях науки и промышленности.
Азот образует множество соединений, среди которых особенно известны аммиак (NH3) и азотная кислота (HNO3). Аммиак используется в производстве удобрений, а азотная кислота – в химической промышленности для синтеза других химических соединений.
Фосфор является кладезем для химической промышленности. Одним из наиболее известных соединений фосфора является фосфорная кислота (H3PO4), которая используется в производстве удобрений и стиральных средств.
Соединения мышьяка и антимона также широко используются в различных отраслях промышленности. Сернокислый антимон (Sb2S3) находит применение в химической промышленности, а мышьяктриоксид (As2O3) используется в производстве стекла и керамики.
Комплексные соединения
Комплексные соединения имеют широкий спектр приложений в различных областях науки и технологии. Они используются в качестве катализаторов в химических реакциях, в медицине для разработки противораковых препаратов, в производстве материалов с определенными свойствами, таких как магнитные материалы и светоизлучающие диоды.
Комплексные соединения обладают различными свойствами, такими как структура, растворимость, цветность и активность. Эти свойства зависят от типа центрального атома, типа и числа лигандов, а также от структуры комплексного иона или атома. Свойства комплексных соединений исследуются с помощью различных спектральных методов, таких как ИК-спектроскопия и УФ-видимая спектроскопия.
Комплексные соединения также могут образовывать различные типы структур, такие как октаэдрические, квадратно-плоские и кубические. Эти структуры могут быть предсказаны с помощью теории поля и наблюдены при помощи методов рентгеноструктурного анализа.
Примеры комплексных соединений:
Хлорид платины(II), гексацанагидрат: PtCl2(H2O)6
Азотат ферроцену: Fe(C5H5)2(NO3)2
Карбонил железа: Fe(CO)5
📹 Видео
Все классы в неорганике за 6 часов | Химия ЕГЭ 2023 | УмскулСкачать

ВСЯ неорганическая классификация за 45 минут! | Химия ОГЭ 2023 | УмскулСкачать

Классификация неорганических соединений | Химия ОГЭ 2022 | УмскулСкачать

39. Классы неорганических соединенийСкачать

СУПЕР СПОСОБ — Как определить классы неорганических соединений? #shorts #youtubeshortsСкачать

Самая ПОДРОБНАЯ классификация неорганических веществ для ЕГЭ по химииСкачать

68 учеников этого НЕ ЗНАЮТ! Таблица Менделеева — Как пользоваться?Скачать

КИСЛОТЫ ХИМИЯ // Урок Химии 8 класс: Кислоты, Кислотный Остаток, Классы Неорганических СоединенийСкачать

ВСЯ ХИМИЯ С НУЛЯ! | Денис Марков | УмскулСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

ХИМИЯ 11 класс: Классификация неорганических соединенийСкачать

Составление формул соединений. 8 класс.Скачать

8 класс. Классификация неорганических веществ.Скачать

Оксиды. 1 часть. 8 класс.Скачать
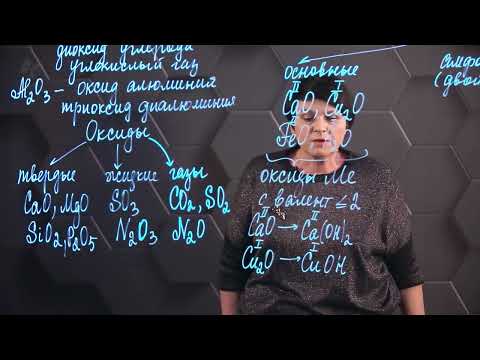
ЕГЭ по Химии 2019. Классификация и номенклатура неорганических веществ. ТеорияСкачать
