Оксиды являются одной из наиболее распространенных классов химических соединений, которые играют важную роль во многих жизненно важных процессах. Оксиды представляют собой соединения, в которых кислород связывается с другими элементами. Важным свойством оксидов является то, что они способны образовывать кислоты или основания при реакции с водой.
Классификация оксидов базируется на различных основных критериях. Один из основных критериев классификации — это химический состав оксидов. Оксиды могут быть бинарными, т.е. состоять только из двух элементов, например, оксиды кислорода с металлами. Они могут быть также тернарными, содержащими кислород в сочетании с элементом и неметаллом.
Кроме того, оксиды можно классифицировать по своему химическому состоянию. Они могут быть кислыми, основными или нейтральными. Кислые оксиды обычно реагируют с водой, образуя кислоты, а основные оксиды взаимодействуют с водой, образуя основания. Нейтральные оксиды обычно не образуют ни кислоты, ни основания при реакции с водой.
- Оксиды металлов
- Неоксиды
- Полиоксиды
- Амфотерные оксиды
- Оксиды полуметаллов
- Карбонилы
- Бориды
- Силаны
- Оксиды неметаллов
- Оксиды кислорода
- Оксиды серы
- Оксиды азота
- Оксиды полуторопереходных металлов
- Оксиды переходных металлов
- Оксиды железа
- Оксиды редкоземельных металлов
- Оксиды лантаноидов
- Оксиды активных элементов
- Оксиды инертных газов
- Оксиды ртутьсодержащих элементов
- 🔥 Видео
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Оксиды металлов
Оксиды металлов могут быть кислотными, основными или амфотерными, в зависимости от своих свойств. Кислотные оксиды реагируют с водой, образуя кислоты, основные оксиды реагируют с водой, образуя основания, а амфотерные оксиды могут взаимодействовать как с кислотами, так и с основаниями.
Одним из самых известных оксидов металлов является оксид железа (III) или железо(III) оксид (Fe2O3). Он обладает красным цветом и широко используется в производстве красок и косметики.
Другим распространенным оксидом металла является оксид алюминия (Al2O3). Он обладает высокой термической и химической стабильностью и широко применяется в производстве керамики, стекла и других материалов.
Оксиды металлов играют важную роль в химической промышленности и научных исследованиях. Изучение и классификация этих соединений помогает понять их свойства и применение в различных областях.
Неоксиды
Неоксиды часто образуются при горении неорганических веществ, при этом они могут иметь различную степень окисления. Например, в результате сжигания серы возникают диоксид серы (SO2) и трехокись серы (SO3), которые являются неоксидами.
Неоксиды могут обладать разнообразными свойствами. Некоторые из них являются сильными окислителями и способны вызывать ожоги или взрывы при контакте с органическими веществами. Другие неоксиды могут быть использованы в качестве катализаторов при различных химических реакциях.
Неоксиды являются важными компонентами в различных отраслях промышленности. Они используются в производстве керамики, стекла, электроники и других материалов. Также неоксиды широко применяются в химической промышленности в качестве реагентов и катализаторов.
Одним из наиболее известных неоксидов является трехокись диазота (N2O3), которая образуется при взаимодействии азота с кислородом. Это сильный окислитель, обладающий ярко-красным цветом и используется в химической аналитике.
Полиоксиды
Полиоксиды обладают различными физическими и химическими свойствами в зависимости от вида и состава. Они могут быть кислотными (содержащими в своей структуре кислород-водородные группы), щелочными (содержащими кислород и одну или несколько щелочных металлов) или нейтральными.
В зависимости от состава и свойств, полиоксиды имеют различные применения. Например, оксид алюминия (Al2O3) является основным компонентом керамики и абразивных материалов. Оксид меди (CuO) используется в производстве пигментов для красок и косметики. Оксид кремния (SiO2) используется в производстве стекла и электронных компонентов, таких как микросхемы и транзисторы.
Исследование полиоксидов имеет важное значение для развития различных областей науки и промышленности, таких как материаловедение, химия, электроника и технология производства. Полиоксиды являются важной частью нашего повседневного мира и широко используются в различных отраслях промышленности и научных исследованиях.
Амфотерные оксиды
Примеры амфотерных оксидов включают оксид алюминия (Al2O3), оксид цинка (ZnO), оксид железа (Fe2O3) и оксид свинца (PbO).
Когда амфотерные оксиды взаимодействуют с кислотами, они образуют соли и воду. Например, реакция оксида алюминия с кислотой соляной:
- Al2O3 + 6HCl → 2AlCl3 + 3H2O
Когда амфотерные оксиды взаимодействуют с щелочами, они образуют соли и воду. Например, реакция оксида цинка с щелочью натрия:
- ZnO + 2NaOH → Na2ZnO2 + H2O
Таким образом, амфотерные оксиды обладают уникальной химической активностью и широко применяются в промышленности и лабораторной практике.
Видео:Оксиды. Химические свойства. 8 класс.Скачать

Оксиды полуметаллов
Некоторые примеры оксидов полуметаллов:
- Оксид германия (GeO2) – белый порошок, который используется в качестве компонента в производстве стекла и керамики.
- Оксид арсения (As2O3) – белый кристаллический порошок, служащий источником арсеновой кислоты и применяющийся в производстве стекла, лакокрасочных материалов, стабилизаторов для резины и др.
- Оксид висмута (Bi2O3) – желтый порошок, применяемый в качестве красителя, а также в производстве лакокрасочных материалов, электроники и фармацевтической промышленности.
Оксиды полуметаллов обладают различными физическими и химическими свойствами, которые определяют их применение в различных отраслях промышленности и науке.
Карбонилы
Карбонилы характеризуются высокой реакционной активностью и обладают различными физическими и химическими свойствами.
Важно отметить, что карбонилы могут быть как органическими, так и неорганическими соединениями. Органические карбонилы содержат карбонильную группу в органическом скелете, а неорганические карбонилы — встречаются в виде металлических соединений.
Органические карбонилы являются одним из наиболее распространенных классов органических соединений. Они присутствуют во многих природных и синтетических веществах, таких как альдегиды, кетоны, карбоновые кислоты, эстеры и др.
Карбонилы могут образовывать разнообразные химические связи и участвовать во множестве реакций. Химические свойства карбонилов связаны с электрофильностью и полярностью карбонильной группы.
Важной реакцией карбонилов является аддиция, при которой на карбонильную группу добавляется атом, группа или ион. Также карбонилы могут подвергаться превращениям, таким как окисление, восстановление, превращение в соли и др.
Карбонилы широко используются в органическом синтезе, фармацевтической, пищевой и других промышленных отраслях.
Изучение карбонилов помогает лучше понять и использовать их в химических реакциях и процессах, а также важность их роли в природе и технологии.
Бориды
Основные свойства боридов:
- Высокая термическая и химическая стабильность.
- Высокая твердость и прочность.
- Низкое электрическое сопротивление.
- Отличная теплопроводность.
- Устойчивость к высоким температурам.
Бориды широко применяются в различных отраслях, таких как электроника, металлургия, аэрокосмическая промышленность и другие.
Одним из наиболее известных боридов является борид кремния (SiB6), который обладает высокой термической и химической стабильностью, используется в производстве электродов, а также в сфере высоких температурных приложений.
Другие примеры боридов включают борид алюминия (AlB12), борид титана (TiB2) и борид циркония (ZrB2), которые широко используются в качестве материалов с высокой твердостью и прочностью.
Силаны
Основные химические свойства силанов связаны с наличием кремниевого атома, который способен образовывать четыре ковалентных связи. Силаны обладают высокой химической реактивностью и способны реагировать с большим числом соединений.
Силаны широко используются в качестве межфазных агентов, адгезивов, кросс-связующих агентов и поверхностно-активных веществ. Их использование позволяет улучшить адгезию между различными материалами, обеспечить прочность и стойкость к воздействию различных химических веществ.
В зависимости от структуры и химических свойств силаны могут быть жидкими, газообразными или твердыми веществами. Они могут образовывать различные химические соединения с другими элементами, такими как водород, кислород, азот, сера и др.
Силаны широко применяются в производстве полимеров, стекла, силикатных материалов, лакокрасочных покрытий и других промышленных изделий. Благодаря своим уникальным свойствам, силаны играют важную роль в современной химической промышленности.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Оксиды неметаллов
Оксиды неметаллов обычно имеют кислотные свойства, так как при растворении в воде они образуют кислоты. Они также могут реагировать с основаниями, образуя соли.
Оксиды неметаллов часто обладают высокой электроотрицательностью, что позволяет им формировать ионные связи с металлами. Особенно известны оксиды таких неметаллов, как кислород, сера, азот, хлор и фосфор.
Некоторые оксиды неметаллов обладают важными промышленными и научными применениями. Например, оксид азота (NO) используется в производстве азотной кислоты, а оксид серы (SO2) — в производстве серной кислоты.
Изучение оксидов неметаллов важно для понимания химических реакций и свойств различных веществ. Они играют важную роль в химической промышленности и науке.
Оксиды кислорода
Оксиды кислорода имеют различные свойства и применения. Например, диоксид углерода играет важную роль в процессе фотосинтеза растений, а также является одним из основных парниковых газов, способных удерживать тепло в атмосфере Земли. Трехокись азота используется в качестве окислителя в различных промышленных процессах и является главным компонентом азотных кислот.
Оксиды кислорода могут быть сильными окислителями и иметь высокую реакционную активность. Они взаимодействуют с различными веществами и могут вызывать окислительные процессы. Некоторые оксиды кислорода используются в качестве реакционных каталитических агентов в различных химических процессах. Они также могут служить важными компонентами при производстве различных материалов и соединений.
Таким образом, оксиды кислорода играют важную роль в химии и имеют широкий спектр свойств и применений.
Оксиды серы
Диоксид серы (SO2) – это газообразное вещество, имеющее резкий запах. Он образуется при сгорании серосодержащих веществ и природных процессах, таких как извержение вулканов. Диоксид серы является одним из основных загрязнителей атмосферного воздуха. Он способен вызывать ряд заболеваний органов дыхания человека.
Триоксид серы (SO3) – это бесцветное газообразное вещество с острым запахом. Он образуется в результате окисления диоксида серы и используется в промышленности для производства кислот, таких как серная кислота. Триоксид серы также является катализатором для ряда химических реакций.
Тетраоксид серы (SO4) – это белые кристаллы или порошок без запаха. Он образуется при полном сгорании серы или серосодержащих соединений. Тетраоксид серы является важным компонентом при производстве серной кислоты, а также используется в других химических процессах.
Оксиды серы обладают различными свойствами и применяются в различных областях промышленности, науки и медицине. Они могут быть ядовитыми и опасными для окружающей среды, поэтому требуются специальные меры предосторожности при работе с ними.
Оксиды азота
Оксид азота (II) (NO), также известный как оксид азота или азотная моноксид, является безцветным газом. Он образуется при сгорании аммиака и используется в промышленности для производства синего красителя азотистого индиго. Оксид азота (II) также является одним из важных компонентов атомосферного загрязнения, так как его выделение является продуктом сгорания топлива в автомобилях и процессах сжигания.
Оксид азота (IV) (NO2), также известный как диоксид азота, является красно-коричневым газом. Он является сильным окислителем и обладает ядовитыми свойствами. Диоксид азота также является основным компонентом смога и атмосферного загрязнения. Он образуется в результате реакции оксида азота (II) с кислородом и обычно присутствует в печных газах.
Оксиды азота играют важную роль в атмосферной химии и как загрязнители окружающей среды. Они являются причиной кислотного дождя и негативно влияют на здоровье человека и окружающую среду.
| Оксид | Формула | Состояние | Свойства |
|---|---|---|---|
| Оксид азота (II) | NO | Газ | Безцветный, обладает слабым запахом, ядовит, является причиной атмосферного загрязнения. |
| Оксид азота (IV) | NO2 | Газ | Красно-коричневый, сильный окислитель, ядовит, причина смога и кислотного дождя. |
Видео:ОКСИДЫ основные кислотные амфотерные как отличить | Оксиды химия 8 классСкачать

Оксиды полуторопереходных металлов
Примеры полуторопереходных металлов, образующих оксиды, включают следующие элементы:
| Металл | Оксид |
|---|---|
| Ванадий (V) | Ванадиев(V) оксид (VO2) |
| Вольфрам (W) | Тунгстен(VI) оксид (WO3) |
| Марганец (Mn) | Марганцев(IV) оксид (MnO2) |
Оксиды полуторопереходных металлов обладают различными физическими и химическими свойствами. Некоторые из них являются полупроводниками и используются в электронике и солнечных батареях. Другие оксиды используются в качестве катализаторов в химических процессах, а также в производстве красок и керамики.
Оксиды полуторопереходных металлов играют важную роль в различных химических реакциях и процессах. Изучение их свойств и применение в различных областях науки и промышленности является актуальной задачей в области химии.
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Оксиды переходных металлов
Оксиды переходных металлов могут быть как ионными, так и ковалентными соединениями. В ионных соединениях, металл образует положительный ион, а кислород образует отрицательный ион. В ковалентных соединениях, кислород образует соединение с металлом, используя свои дополнительные электроны для образования ковалентных связей.
Оксиды переходных металлов могут иметь различные степени окисления металла, что влияет на их свойства. Некоторые оксиды могут быть кислотными или щелочными, что зависит от степени окисления металла. Также оксиды переходных металлов могут иметь различную структуру и состояние природы — от твердого до газообразного.
Некоторые примеры оксидов переходных металлов:
- Оксид железа (Fe2O3) — является красным кристаллическим веществом и применяется в производстве красок и пигментов;
- Оксид меди (CuO) — используется в качестве катализатора и пигмента;
- Оксид цинка (ZnO) — применяется в солнечных батареях и косметике;
- Оксид марганца (MnO2) — используется в производстве батареек и керамики;
Таким образом, оксиды переходных металлов являются важными соединениями с разнообразными свойствами и применениями в различных областях промышленности и науки.
Оксиды железа
Главными оксидами железа являются:
- Оксид железа(III) (Fe2O3) – также известен как гематит. Он обладает красным цветом и используется в производстве красок и керамики. Гематит является нерастворимым в воде веществом.
- Оксид железа(II) (FeO) – известен под названием магнетит. Он имеет черный цвет и обладает магнитными свойствами. Магнетит используется в производстве магнитов и косметических средств.
- Оксид железа(IV) (Fe3O4) – также известен как магнетит, но отличается от оксида железа(II) тем, что содержит ионы железа в разных степенях окисления. Магнетит является часто встречающимся минералом и используется в производстве пигментов, магнитов и компасов.
Оксиды железа встречаются как природные минералы и могут быть получены в ходе различных химических реакций. Они находят применение в разных областях, от строительства до электроники.
Видео:Классификация оксидов | 8-11 классыСкачать

Оксиды редкоземельных металлов
Редкоземельные металлы включают в себя группу элементов, которые расположены в самом нижнем ряду периодической таблицы, внутри f-блока. Эти металлы имеют уникальные химические свойства, включая высокую реактивность и способность образовывать различные соединения.
Одним из наиболее распространенных типов соединений редкоземельных металлов являются оксиды. Оксиды редкоземельных металлов характеризуются присутствием кислорода в их составе. Они образуются в результате реакции металлов с кислородом воздуха или воды.
Оксиды редкоземельных металлов обычно имеют высокую температуру плавления и кипения и обладают различными физическими и химическими свойствами. Некоторые из них имеют полупроводниковые свойства и используются в электронике и технологии.
Некоторые из наиболее известных оксидов редкоземельных металлов:
- Оксид лантана (La2O3)
- Оксид церия (CeO2)
- Оксид прасеодима (Pr6O11)
- Оксид неодима (Nd2O3)
- Оксид прометия (Pm2O3)
- Оксид самария (Sm2O3)
- Оксид европия (Eu2O3)
- Оксид гадолиния (Gd2O3)
Каждый из этих оксидов имеет свои уникальные свойства и применения. Они могут использоваться в производстве керамики, катализаторов, лазеров и других технологических процессах.
Видео:Получение и химические свойства ОКСИДОВ 8 класс | ПРИНЦИП составления реакций с участием оксидовСкачать

Оксиды лантаноидов
Одной из характеристик лантаноидов является способность образовывать различные оксиды. Оксиды лантаноидов имеют формулу Ln2O3, где Ln обозначает один из лантаноидов.
Оксиды лантаноидов обладают рядом уникальных свойств. Например, они являются твердыми веществами с высокой температурой плавления. Большинство оксидов имеют белый цвет, но некоторые из них могут иметь оттенки, от желтого до красного.
Некоторые оксиды лантаноидов являются полупроводниками. Это означает, что они обладают как проводящим, так и непроводящим свойствами в зависимости от температуры и других факторов.
Оксиды лантаноидов также широко используются в различных промышленных отраслях. Например, они используются в производстве катализаторов, электронных устройств, лазеров и фосфоресцентных материалов.
Таким образом, оксиды лантаноидов представляют собой важный класс соединений, обладающих уникальными свойствами и имеющих широкий спектр применений.
Видео:Химия 8 класс (Урок№15 - Оксиды: классификация, номенклатура.)Скачать

Оксиды активных элементов
Оксиды активных элементов обладают разнообразными свойствами. Некоторые из них являются кислотными оксидами и способны реагировать с водой, образуя кислоты. Примерами таких оксидов являются диоксид серы (SO2), который при взаимодействии с водой образует серную кислоту, и оксид азота (NO2), который образует азотную кислоту.
Другие оксиды активных элементов являются щелочными оксидами и реагируют с водой, образуя щелочи. Примером такого оксида является оксид натрия (Na2O), который взаимодействует с водой, образуя гидроксид натрия (NaOH).
Некоторые оксиды активных элементов могут обладать амфотерными свойствами, то есть они могут реагировать и с кислотами, и с щелочами. Примером такого оксида является оксид алюминия (Al2O3), который может реагировать как с кислотами, так и с щелочами.
Оксиды активных элементов широко используются в промышленности и в жизни. Например, диоксид серы используется в производстве серной кислоты и серной мази, а оксид натрия применяется в производстве стекла и щелочи.
Таким образом, оксиды активных элементов представляют собой важный класс оксидов, который обладает разнообразными свойствами и находит широкое применение в различных отраслях промышленности.
Видео:Оксиды. 1 часть. 8 класс.Скачать
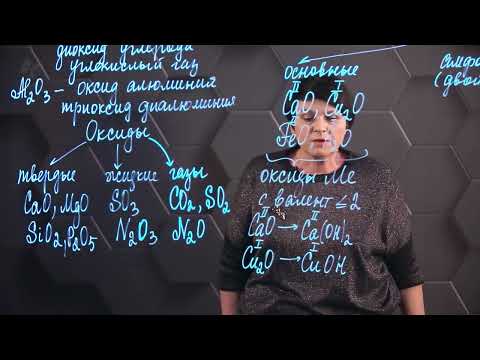
Оксиды инертных газов
Инертные газы характеризуются высокой степенью неактивности и стабильности, поэтому их оксиды обычно являются крайне слабыми окислителями или восстановителями. Они образуются путем прямого сочетания инертного газа с кислородом в определенных условиях.
Инертные газы обладают низкой реакционной способностью и не образуют химических связей с другими элементами. Однако, при высоких температурах, инертные газы могут преодолеть свою неактивность и произвести оксиды соответствующих элементов.
Примеры оксидов инертных газов включают гелиевый (HeO2), неоновый (NeO2), аргоновый (ArO2) и криптоновый (KrO2) оксиды. Эти соединения обычно нестабильны и быстро разлагаются при обычных условиях.
Оксиды инертных газов являются редкими и применяются в основном в научных исследованиях. Они не имеют широкого промышленного или практического применения.
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Оксиды ртутьсодержащих элементов
Оксиды ртутьсодержащих элементов представляют собой вещества, состоящие из ртути и кислорода. В природе существуют различные оксиды ртутьсодержащих элементов, каждый из которых обладает своими особыми свойствами.
Один из наиболее известных оксидов ртутьсодержащих элементов — это оксид ртути (II), обозначаемый формулой HgO. Он имеет желто-красный цвет и используется в качестве пигмента в косметической и художественной промышленности. Оксид ртути (II) обладает высокой токсичностью и может вызывать отравление при длительном воздействии.
Другим примером оксида ртутьсодержащих элементов является оксид ртути (I), обозначаемый формулой Hg2O. Он имеет красный цвет и используется в медицине, например, для лечения инфекционных заболеваний. Однако оксид ртути (I) также является ядовитым веществом и может вызывать серьезные побочные эффекты.
Оксиды ртутьсодержащих элементов часто используются в различных отраслях промышленности, но их использование требует особой осторожности из-за их высокой токсичности. При работе с оксидами ртутьсодержащих элементов необходимо соблюдать все меры безопасности и работать в хорошо вентилируемых помещениях.
🔥 Видео
Характеристика и химические свойства оксидов | Химия ЕГЭ 10 класс | УмскулСкачать

Оксиды, их классификация и свойства. Химия 8 классСкачать

Типы оксидов за 2 минуты (8 классам)Скачать
Химические свойства ОСНОВАНИЙ 8 класс | ПРИНЦИП составления ЛЮБОЙ реакции с участием основанийСкачать

СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

Химия 8 класс (Урок№16 - Свойства, получение, применение оксидов.)Скачать

Основания. 8 класс.Скачать

40. Оксиды. КлассификацияСкачать

Открытый урок: Средняя школа. Химия 8 класс. Оксиды, их классификация и свойстваСкачать

Габриелян О. С. 8 класс §41 "Оксиды, их классификация и свойства".Скачать
