Буферные растворы – это особый тип растворов, обеспечивающих относительную стабильность рН в определенном диапазоне. Они играют важную роль во многих процессах, связанных с химическими реакциями, биологическими системами и технологическими процессами. Классификация буферных растворов позволяет понять основные принципы их конструкции и использования. В данной статье рассмотрим различные виды буферных растворов и принципы их работы.
Существует несколько способов классификации буферных растворов. Один из них основан на типе используемых компонентов. Например, наиболее распространенными видами буферных растворов являются растворы смеси слабой кислоты и ее соли. В таких растворах реакция между слабой кислотой и ее солью позволяет поддерживать стабильный уровень рН.
Кроме того, буферные растворы можно классифицировать по их действию. Например, существуют буферные растворы, которые поддерживают кислотную среду, а также растворы, которые поддерживают щелочную среду. Они используются в различных областях науки и промышленности, где требуется стабильный уровень рН для успешного проведения химических и биологических процессов.
- Раздел 1: Определение буферного раствора
- Подраздел 1.1: Определение основного понятия
- Подраздел 1.2: Значение буферных растворов в химии
- Раздел 2: Классификация буферных растворов
- Подраздел 2.1: По химическому составу
- Подраздел 2.2: По механизму действия
- Подраздел 2.3: По pH значениям
- Раздел 3: Виды буферных растворов
- Подраздел 3.1: Универсальные буферные растворы
- Подраздел 3.2: Специализированные буферы
- Раздел 4: Принципы работы буферных растворов
- Подраздел 4.1: Реакция буферной системы на добавление кислоты
- Подраздел 4.2: Реакция буферной системы на добавление щелочи
- Подраздел 4.3: Влияние концентрации реагентов на pH
- 💡 Видео
Видео:Буферные растворы. 1 часть. 11 класс.Скачать

Раздел 1: Определение буферного раствора
Буферные растворы можно классифицировать по различным критериям, таким как их тип, концентрация буферной пары и принцип действия.
Существует несколько различных типов буферных растворов, включая амфотерные и буферы слабых кислот и слабых оснований.
Концентрация буферной пары может быть фиксированной или изменяемой, что позволяет буферному раствору эффективно управлять pH в широком диапазоне.
Принцип действия буферного раствора заключается в том, что он содержит слабую кислоту и/или слабое основание, которые реагируют с добавленной кислотой или щелочью, чтобы поддерживать стабильный pH.
Буферные растворы широко используются в лабораторных условиях, медицине, фармакологии и других областях, где поддержание постоянного pH является важным фактором.
Подраздел 1.1: Определение основного понятия
Основным понятием в классификации буферных растворов является их способность поддерживать постоянный pH путем нейтрализации добавляемых кислот или щелочей. Буферные растворы состоят из конъюгированных пар кислоты и основания, которые взаимодействуют с добавленными ионами водорода или гидроксида, поддерживая стабильное значение pH.
Подраздел 1.2: Значение буферных растворов в химии
Буферные растворы представляют собой комбинацию слабой кислоты или щелочи с ее солью. Для создания буферного раствора необходимы элементы, которые будут служить как слабая кислота и ее соль, а также вода и система для поддержания стабильного pH.
Буферные растворы используются во многих областях химии, включая биохимию, фармакологию, аналитическую химию и другие. Они широко применяются в лабораторных исследованиях, производстве лекарств, фармакологии и медицине.
| Применения буферных растворов в химии |
|---|
| Процессы регулирования pH |
| Создание оптимальных условий для реакций |
| Поддержание стабильности и сохранение активности ферментов |
| Создание реакционных сред с постоянным pH |
Видео:pH и буферные растворы | Медицинская химия | МедвузаСкачать

Раздел 2: Классификация буферных растворов
Буферные растворы классифицируются по нескольким параметрам:
- Положительный тип буфера: классификация основана на концентрации ионов водорода (pH) раствора. Буферы этого типа могут быть кислотными, щелочными или нейтральными.
- Химический состав: буферы могут состоять из разных химических соединений, таких как соли, кислоты и щелочи. Некоторые примеры химических буферов включают фосфатный буфер, ацетатный буфер и трифторметановый буфер.
- Концентрация: буферы могут быть различной концентрации, что позволяет контролировать и регулировать pH-уровень раствора с большей точностью.
- Применение: буферные растворы могут быть специально разработаны для определенных приложений, таких как биологические эксперименты, химический анализ, медицинские исследования и т.д.
Каждый тип буферного раствора имеет свои особенности и применяется в соответствии с требованиями исследования или процесса. Правильный выбор буферного раствора является важным шагом для успешного проведения эксперимента или производственного процесса.
Подраздел 2.1: По химическому составу
Буферные растворы могут быть классифицированы по химическому составу на следующие виды:
| Вид буферного раствора | Принципиальное представление |
|---|---|
| Амфотерные буферные растворы | Содержат как слабые кислоты, так и слабые основания в равных концентрациях |
| Кислотные буферные растворы | Содержат слабую кислоту и ее соль сильной основы |
| Основные буферные растворы | Содержат слабую основу и ее соль сильной кислоты |
| Смесевые буферные растворы | Содержат две или более слабых кислот и/или оснований |
Каждый вид буферного раствора имеет свои уникальные химические свойства, которые позволяют поддерживать постоянное pH в растворе. Знание химического состава буферных растворов является важным для определения их эффективности и правильной работы в конкретных приложениях.
Подраздел 2.2: По механизму действия
Буферные растворы могут быть классифицированы по механизму их действия. Существуют следующие виды буферных растворов:
- Кислотно-щелочные буферные растворы. Они основаны на реакции образования солей слабых кислот и слабых основ.
- Амфотерные буферные растворы. Они могут действовать как кислоты и основания, в зависимости от условий окружающей среды.
- Комплексообразующие буферные растворы. Они содержат комплексообразующие агенты, которые создают устойчивые комплексы с ионами металлов и обеспечивают стабильность раствора.
- Органические буферные растворы. Они состоят из органических веществ, часто аминокислот, которые способны поддерживать стабильность pH раствора.
Каждый из этих видов буферных растворов имеет свои особенности и применяется в различных областях науки и техники.
Подраздел 2.3: По pH значениям
В зависимости от значения pH буферные растворы можно классифицировать на несколько групп:
- Кислотные буферные растворы. Они обладают pH значением ниже 7 и используются для поддержания кислой среды. Примером являются буферы на основе уксусной кислоты.
- Щелочные буферные растворы. Они имеют pH значение выше 7 и используются для поддержания щелочной среды. Примером таких буферов являются растворы на основе гидроксида натрия.
- Нейтральные буферные растворы. Они имеют pH значение около 7 и используются для поддержания нейтральной среды. Примером таких растворов являются фосфатные буферы.
- Амфотерные буферные растворы. Они обладают pH значением, которое может быть как кислым, так и щелочным, в зависимости от внешних условий. Примером таких буферов являются растворы на основе аминокислот и белков.
Классификация буферных растворов по pH значению является важной для выбора правильного буфера в зависимости от требуемой среды и типа эксперимента или процесса.
Видео:Буферные системы, ацидоз и алкалоз, ур-ие Гендерсона-Гассельбаха (Атриум и Учим химию)Скачать

Раздел 3: Виды буферных растворов
Буферные растворы представляют собой специально приготовленные смеси химических веществ, обладающие способностью устойчиво поддерживать постоянные значения pH. В зависимости от используемых компонентов и их соотношения, буферные растворы могут быть разных видов.
Самыми распространенными видами буферных растворов являются:
- Фосфатные буферы
- Ацетатные буферы
- Карбонатные буферы
- Триглициновый буфер
- Гептаноловый буфер
- Тис-Глис буфер
Каждый из этих видов буферных растворов имеет свои особенности и применение в различных областях науки и промышленности. Важно правильно подобрать вид буферного раствора в зависимости от требуемого pH и химической среды, в которой он будет использоваться.
Фосфатные буферы используются в биологических и медицинских исследованиях, так как они обеспечивают растворы с pH близким к физиологическому. Ацетатные буферы хорошо работают при низком pH и широко применяются в синтезе органических соединений. Карбонатные буферы используются для поддержания постоянного pH в различных системах, включая промышленные процессы. Триглициновый буфер широко используется в биохимических исследованиях благодаря своей универсальности и низкой токсичности. Гептаноловый буфер используется в фотографической индустрии для поддержания постоянного pH в процессе остановки развития пленки. Тис-Глис буфер используется в генетических исследованиях для поддержания постоянного pH во время амплификации ДНК.
Выбор конкретного вида буферного раствора зависит от задачи и требований, поэтому важно хорошо разбираться в свойствах и применении разных видов, чтобы правильно подобрать нужный раствор для конкретной задачи.
Подраздел 3.1: Универсальные буферные растворы
В основе универсальных буферных растворов лежат сильные кислоты и основания, которые образуют стабильные соли. Эти растворы имеют большую концентрацию буферных компонентов, что обеспечивает их способность быстро устранять добавленные кислоты или основания и поддерживать pH на неизменном уровне.
Один из наиболее известных универсальных буферных растворов — раствор Фосфатного буфера. Он состоит из двух компонентов: дихромовая соль и монодисильная соль фосфорной кислоты.
Универсальные буферные растворы широко применяются в биологических и химических исследованиях, а также в медицинской диагностике и анализе. Они позволяют поддерживать стабильные условия эксперимента и обеспечивают точные результаты.
Преимущества использования универсальных буферных растворов включают возможность работы в различных условиях и удобство в использовании. Их широкое применение связано с их высокой эффективностью и надежностью.
Подраздел 3.2: Специализированные буферы
Одним из примеров специализированных буферов являются буферы Трис-Глицин и Лисин-Глицин, которые используются в электрофорезе белков для создания оптимальных условий разделения белковых молекул.
Еще одним примером является буферный раствор Гепес, который используется в молекулярной биологии и генетике для поддержания постоянного pH в процессе экспериментов с ДНК и РНК.
Специализированные буферы могут также содержать добавки, которые улучшают стабильность и функциональность раствора, а также предотвращают нежелательные реакции или взаимодействия.
Выбор специализированного буфера зависит от конкретной цели и требований эксперимента. Он должен быть выбран с учетом химических и физических свойств реагентов и условий эксперимента.
Видео:Нормальная физиология | Регуляция кислотно-основного состояния крови. Буферные системы кровиСкачать

Раздел 4: Принципы работы буферных растворов
Главное свойство буферных растворов заключается в их способности устойчиво поддерживать определенное pH-значение. Это достигается путем наличия в растворе слабой кислоты и ее конъюгированного основания, или слабой основы и ее конъюгированной кислоты. Эти компоненты образуют спаренную кислотно-основную пару, которая может отдавать или принимать протоны для регулирования pH-значения.
Если раствор становится слишком кислым, буферный раствор может принять лишние протоны, чтобы уравновесить кислотность. Если раствор становится слишком основным, буферный раствор может отдать протоны, чтобы снизить щелочность.
Важно отметить, что буферные растворы имеют определенное пределы эффективности. Если кислотность или щелочность становятся слишком высокими, буферный раствор больше не сможет компенсировать изменения pH-значения. Поэтому важно правильно выбирать буферный раствор в соответствии с задачами и требуемым pH-значением.
Принципы работы буферных растворов использованы во многих приложениях, таких как биологические и химические исследования, анализ пищевых продуктов, фармацевтическая и медицинская промышленность. Буферные растворы существенно упрощают регулирование pH-значения в различных системах и обеспечивают стабильность и точность результатов экспериментов.
Подраздел 4.1: Реакция буферной системы на добавление кислоты
Когда в буферный раствор добавляется кислота, происходит следующая реакция:
- Кислота передает протон H+ буферному компоненту (обычно слабой основе) в растворе.
- Буферный компонент принимает протон H+ и образует кислоту, что позволяет поддерживать постоянный pH раствора.
Эта реакция позволяет буферной системе эффективно сопротивляться изменению pH даже при большом добавлении кислоты в раствор.
Подраздел 4.2: Реакция буферной системы на добавление щелочи
Буферная система представляет собой раствор, способный устойчиво поддерживать постоянный рН при добавлении кислоты или щелочи. Когда в раствор добавляют щелочь, происходит изменение концентрации ионов водорода (Н+) и гидроксидных ионов (ОН-) в системе.
При добавлении щелочи, ионы гидроксида протекают следующую реакцию:
- Гидроксидные ионы (ОН-) реагируют с протонами (Н+) буферной системы, образуя молекулы воды (H2O).
- Реакция обратима и представляет собой ионно-молекулярную реакцию.
- Концентрация ионов водорода (Н+) в системе уменьшается, что приводит к увеличению рН.
- Буферная система пытается компенсировать изменение рН и восстанавливает его к начальному значению, регулируя концентрацию ионов водорода (Н+).
Таким образом, реакция буферной системы на добавление щелочи заключается в нейтрализации гидроксидных ионов (ОН-) и восстановлении и поддержании постоянного рН раствора.
Подраздел 4.3: Влияние концентрации реагентов на pH
Концентрация реагентов в буферных растворах играет важную роль в определении их pH. Изменение концентрации одного или нескольких реагентов может изменить pH буферного раствора.
При увеличении концентрации основного компонента буферного раствора, его способность принимать протоны увеличивается. Это приводит к снижению pH раствора, так как большая часть протонов будет приниматься основным компонентом.
С другой стороны, повышение концентрации кислотного компонента буферного раствора приводит к увеличению его способности отдавать протоны. В результате pH раствора повышается, так как большая часть протонов будет отдаваться кислотным компонентом.
Таким образом, изменение концентрации реагентов в буферном растворе может привести к изменению pH и тем самым влиять на его буферные свойства. Правильный выбор концентрации реагентов позволяет поддерживать стабильный pH в широком диапазоне условий и обеспечивает эффективную буферизацию раствора.
💡 Видео
Введение в буферные растворы (видео 1) | Буферные растворы | ХимияСкачать

Буферная ёмкость (видео 7) | Буферные растворы | ХимияСкачать

Расчёты pH буферных растворов (видео 5) | Буферные растворы | ХимияСкачать

Буферные растворыСкачать

Буферные растворы 🧩: виды и принцип работы 🔥 | По понятиям 😈Скачать

Буферные растворы. 2 часть. 11 класс.Скачать

Буферные растворы и уравнение Гендерсона-ГассельбахаСкачать

Типы буровых растворов и соответствующих реагентовСкачать

Буферные растворы. Практическая часть. 11 класс.Скачать

Связь pH и pKa для буферных растворов (видео 6) | Буферные растворы | ХимияСкачать
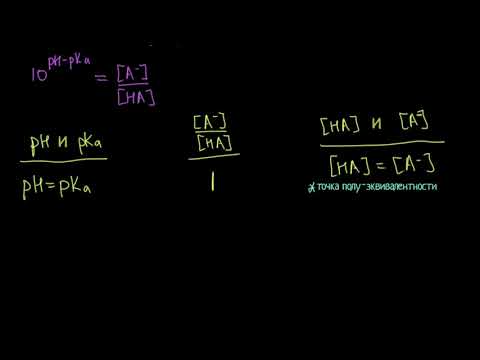
Буферные растворы и уравнение Хендерсона-Хассельбаха (видео 4) | Буферные растворы | ХимияСкачать

Химия | Дисперсные системыСкачать

Физиология крови. РН-крови. КЩР. Буферная система крови.#45Скачать

Теории кислот, оснований и растворов. Теория Брёнстеда-Лоури. 11 класс.Скачать

Классификация и типы буровых растворов и реагентов для регулирования их свойств.Скачать
