Оксиды – это важная группа неорганических соединений, состоящих из элемента и кислорода. Они играют ключевую роль как в природных процессах, так и в промышленности. Все оксиды состоят из двух компонентов: Металлического элемента и кислорода. Некоторые из них являются важными минералами, другие используются в качестве катализаторов, а еще другие – как основные компоненты стекла и керамики.
Структура оксидов может быть очень разнообразной. Все зависит от свойств металла и его атомного состава. Например, диоксид кремния (SiO2), который является основным компонентом песка, имеет аморфную структуру – атомы кремния и кислорода расположены в хаотическом порядке. В свою очередь, оксид алюминия (Al2O3) имеет кристаллическую структуру, где атомы расположены в определенном порядке.
Функции оксидов весьма разнообразны. Некоторые из них являются катализаторами – веществами, которые ускоряют химические реакции, не участвуя в них непосредственно. Например, оксид железа (Fe2O3) является важным компонентом катализаторов, используемых в процессе гидрокрекинга для получения бензина. Другие оксиды служат основой для производства стекла, керамики и электроники. Они придают этим материалам необходимые свойства прозрачности, твердости и электропроводимости.
- Что такое оксиды?
- Значение оксидов в природе
- Основные составные элементы оксидов
- Кислород
- Физические свойства кислорода
- Химические свойства кислорода
- Роль кислорода в оксидах
- Металлы
- Различные металлы в составе оксидов
- Физические свойства металлов
- Химические свойства металлов
- Роль металлов в оксидах
- Функции оксидов
- Роль оксидов в природе
- Промышленное применение оксидов
- Влияние оксидов на окружающую среду
- 🎦 Видео
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Что такое оксиды?
Оксиды представляют собой одну из наиболее широко распространенных классов неорганических соединений, имеющих в своем составе кислород. Они образуются в химических реакциях, в результате которых металлы соединяются с кислородом. Оксиды обладают разнообразными физическими и химическими свойствами.
Состав оксидов включает атомы кислорода и другие элементы, такие как металлы или неметаллы. При этом, атомы кислорода обычно находятся в отрицательном агрегатном состоянии, а другие элементы обеспечивают положительный заряд. Эти элементы могут образовывать разные соединения и обладать различными химическими свойствами.
Оксиды выполняют различные функции в природе и в промышленности. Некоторые из них являются основными строительными материалами, такими как глина и песок. Другие оксиды используются в производстве стекла, керамики и красок. Одни оксиды имеют полезные свойства в медицине и в производстве лекарств, другие используются в качестве катализаторов при химических реакциях.
Оксиды также играют важную роль в природных процессах. Например, оксиды участвуют в образовании горных пород и почвы. Некоторые из них вступают в реакцию с водой, образуя кислоты, что может привести к изменению химического состава природных вод и почвы.
Изучение оксидов является важной частью химии и позволяет лучше понять и предсказать их свойства и использование. Химические реакции с оксидами могут быть полезными для различных промышленных процессов и природных явлений.
Видео:Получение и химические свойства ОКСИДОВ 8 класс | ПРИНЦИП составления реакций с участием оксидовСкачать

Значение оксидов в природе
Оксиды также встречаются в почве и воде. Например, оксиды железа придают почве красный или жёлтый цвет. Оксиды алюминия, такие как бокситы, являются основными рудами алюминия и используются в промышленности для производства металла. Кроме того, оксиды магния и кальция используются в сельском хозяйстве в качестве добавок для улучшения почвы.
Оксиды также играют важную роль в геологических процессах, таких как образование пород и изменение состава земной коры. Например, оксиды железа участвуют в процессе окисления, который приводит к образованию ржавчины и геологическим переформированиям. Оксиды также могут участвовать в реакциях, которые приводят к образованию руд и драгоценных камней.
Значение оксидов в природе невозможно переоценить. Они не только являются составными элементами минералов и руд, но и участвуют во множестве химических и геологических процессов, формирующих Землю и влияющих на ее окружающую среду.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Основные составные элементы оксидов
Металлы — это химические элементы, которые обычно имеют металлический блеск, проводят тепло и электричество, обладают высокой пластичностью и деформируемостью. Некоторые из основных металлических элементов, составляющих оксиды, включают алюминий (Al), железо (Fe), медь (Cu) и цинк (Zn).
Неметаллы — это химические элементы, которые обычно не имеют металлического блеска, не проводят тепло и электричество, и могут быть хрупкими и легко изменяться. Некоторые из основных неметаллических элементов, составляющих оксиды, включают кислород (O), серу (S), фосфор (P) и углерод (C).
Полуметаллы — это химические элементы, обладающие свойствами как металлов, так и неметаллов. Они имеют свойства проводимости и полупроводников, а также хрупкость и особенности неметаллов. Некоторые из основных полуметаллических элементов, составляющих оксиды, включают кремний (Si), германий (Ge) и селен (Se).
В составе оксидов эти составные элементы играют важную роль в их свойствах и химических реакциях. Кислород обычно играет роль оксиданта и важен для процессов окисления и восстановления. Другие составные элементы придают оксидам свои характеристики, такие как проводимость электричества, способность к реакциям, стабильность итд.
Видео:Как строить структурные формулы быстро, как ФЛЭШ — Мое полное РуководствоСкачать

Кислород
Кислород выполняет важную функцию в оксидах, так как является активным окислителем. В реакциях окисления кислород обычно получает электроны от других элементов, что позволяет ему принимать участие в различных процессах, таких как горение и дыхание.
Кроме того, кислород может образовывать связи с другими элементами, такими как водород, углерод и азот и образовывать соединения, такие как вода (H2O) и углекислый газ (CO2). Эти соединения играют важную роль в жизни на Земле и могут выполнять различные функции, такие как поддержание жизни организмов и участие в биохимических реакциях.
Физические свойства кислорода
Физическое состояние: Кислород является газообразным веществом при температуре выше -183 °C. Однако при более низких температурах он может превращаться в жидкость или твердое вещество.
Цвет и запах: Кислород – безцветный и без запаха газ. Это позволяет ему находить широкое применение в различных областях, включая медицину, промышленность и научные исследования.
Плотность и вязкость: Кислород имеет большую плотность и вязкость по сравнению с воздухом. Это позволяет его использовать в качестве поддерживающего газа в сжатом виде или в жидком состоянии.
Температура кипения и плавления: Температура кипения кислорода составляет -183 °C, а температура плавления -218,79 °C. Это означает, что при низких температурах кислород может переходить в жидкое или твердое состояние.
Растворимость: Кислород растворяется в воде, однако растворимость зависит от температуры и давления. В холодной воде растворимость кислорода выше, чем в горячей.
Теплоемкость: Кислород обладает высокой теплоемкостью, что позволяет ему сохранять тепло и энергию при реакциях и физических процессах.
Понимание и использование физических свойств кислорода являются важной частью многих научных и промышленных отраслей. Знание этих свойств позволяет контролировать, хранить и использовать кислород в соответствии с требованиями и потребностями.
Химические свойства кислорода
Первое заметное свойство кислорода — его реакционная способность. Кислород очень активный элемент и легко вступает во взаимодействие с другими веществами. Основное проявление этой свойства — способность кислорода окислять другие вещества.
Одно из наиболее известных свойств кислорода — его растворимость в воде. Кислород входит в состав воздуха и растворяется в воде при образовании раствора. Это свойство имеет огромное значение в биохимических процессах и дыхании живых организмов.
Кислород также обладает свойством образовывать сильные оксиды. Он вступает в реакцию с большинством элементов и образует оксиды. Оксиды кислорода, такие как оксид углерода (СО2) и оксид азота (NO2), являются важными составными частями веществ, играющих роль во многих процессах и реакциях.
Еще одно важное свойство кислорода — поддержание горения. Он является незаменимым компонентом для горения большинства органических веществ. Без наличия кислорода горение невозможно.
Роль кислорода в оксидах
Оксиды состоят из кислорода, который связан с другими элементами, такими как металлы или неметаллы. Соединения на основе металлов содержат ион кислорода, который сформирован при окислении данного металла. В случае оксидов с неметаллами, происходит образование ковалентной связи между атомами кислорода и неметалла.
Кислород в оксидах играет ключевую роль в определении их свойств и применений. Благодаря наличию кислорода, оксиды обладают реакционной способностью, могут быть окисленными или восстановленными.
Оксиды с металлами обычно обладают кислотными свойствами, поскольку ион кислорода может принимать отрицательный заряд. В свою очередь, оксиды с неметаллами могут быть основными или амфотерными, благодаря способности иона кислорода принимать положительный заряд.
Важно отметить, что наличие кислорода в оксидах влияет на их физические свойства, такие как температура плавления и кристаллическая структура. Кроме того, кислород в оксидах определяет их химическую активность и реакционную способность, влияет на их степень окисления и реакции с другими веществами.
Таким образом, роль кислорода в оксидах является неотъемлемой, определяя их химические, физические и реакционные свойства, а также их применение в различных областях науки и техники.
Видео:40. Оксиды. КлассификацияСкачать

Металлы
Металлы обычно представляют собой твердые вещества, состоящие из атомов, расположенных в кристаллической решетке. Они имеют металлический блеск и способны отдавать электроны, что делает их хорошими проводниками электричества.
Металлы играют важную роль в оксидах, так как они являются активными элементами, способными вступать во взаимодействие с кислородом и образовывать соединения. Они выступают в роли катионов и определяют основные свойства оксидов, такие как проводимость и реакционная способность.
Некоторые из наиболее известных металлов, являющихся частями оксидов, включают алюминий, железо, медь, свинец, цинк и другие. Каждый из этих металлов имеет свои уникальные свойства и способности взаимодействия с кислородом, что влияет на окончательные свойства оксидов.
Различные металлы в составе оксидов
Некоторые металлы, такие как алюминий и железо, образуют оксиды, которые широко применяются в различных отраслях промышленности. Например, оксид алюминия (Al2O3) является основным компонентом алюминиевой фольги и обладает высокой теплоотражающей способностью. Оксид железа (Fe2O3), также известный как гематит, используется в производстве красок, металлических порошков и компонентов для литейных отливок.
Другие металлы, такие как золото и серебро, образуют оксиды, которые используются в ювелирной промышленности. Например, оксид золота (Au2O3) используется для создания красивых золотых украшений, а оксид серебра (Ag2O) используется для получения серебряных покрытий.
Также существуют оксиды металлов, которые обладают специфическими свойствами и находят применение в различных областях. Например, оксид меди (CuO) используется в электронике и катализе, а оксид цинка (ZnO) — в производстве косметических средств и солнцезащитных кремов.
Таким образом, различные металлы в составе оксидов выполняют различные функции и находят применение в разных отраслях промышленности и науке.
Физические свойства металлов
- Отличная тепло- и электропроводность. Металлы обычно хорошо проводят тепло и электричество. Это связано с наличием в их структуре свободных электронов, которые могут свободно перемещаться.
- Пластичность и податливость. Металлы легко поддаются обработке и могут быть прокатаны, выдавлены или вытянуты в различные формы без разрушения.
- Относительно высокая плотность. Металлы обычно обладают высокой плотностью, что означает, что их масса на единицу объема может быть сравнительно большой.
- Высокая температура плавления и кипения. Большинство металлов имеют высокие температуры плавления и кипения, что делает их полезными для множества промышленных приложений.
- Металлы могут быть магнитными. Некоторые металлы, такие как железо, никель и кобальт, обладают свойством быть магнитными и притягиваться к магниту.
Эти физические свойства металлов делают их полезными для широкого спектра применений, от строительства и электротехники до изготовления оружия и медицинских инструментов. Их уникальные свойства делают металлы одними из самых важных материалов в современном мире.
Химические свойства металлов
Одной из основных характеристик металлов является их способность к реакции с кислородом. Взаимодействие металлов с кислородом приводит к образованию металлических оксидов. Оксиды металлов играют важную роль в различных сферах нашей жизни, таких как производство материалов, электроника и химическая промышленность.
Помимо оксидов, металлы могут образовывать и другие соединения, такие как гидриды, карбиды, нитриды и сульфиды. Гидриды – это вещества, в которых металл связан с водородом. Карбиды, нитриды и сульфиды – это соединения, в которых металл связан соответственно с углеродом, азотом и серой.
Химические свойства металлов определяют их способность взаимодействовать с другими элементами и соединениями. Взаимодействие металлов с другими веществами может приводить к образованию новых соединений, обладающих различными свойствами и применением.
Одним из примеров химического взаимодействия металлов является окислительно-восстановительные реакции, когда металл способен отдать электроны другому веществу или принять электроны от другого вещества. Это свойство металлов широко используется в электрохимии и электротехнике.
Таким образом, химические свойства металлов играют важную роль в различных областях науки и промышленности. Знание данных свойств позволяет предсказывать и изучать реакции металлов и их соединений, что способствует развитию новых материалов и технологий.
Роль металлов в оксидах
Металлы в оксидах выполняют несколько функций. Во-первых, они обеспечивают стабилизацию ионообразующего элемента – кислорода. Металлы вносят свои дополнительные электроны для образования общей электронной структуры. Это позволяет увеличить устойчивость оксидов и их способность к образованию химических связей.
Во-вторых, металлы в оксидах обеспечивают электропроводность. Большинство металлических оксидов обладает металлическими свойствами, такими как теплопроводность и электропроводность. Это связано с наличием свободных электронов у металлов, которые перемещаются по структуре оксида и обеспечивают токопроводящие свойства.
Кроме того, металлы в оксидах определяют их физические и химические свойства, такие как температурная устойчивость, плотность и растворимость. Валентностный статус металла в оксиде может влиять на реакционную способность соединения, его кислотность или основность.
Таким образом, металлы играют неотъемлемую роль в формировании свойств и функций оксидов. Их присутствие позволяет создавать разнообразные соединения с различными свойствами и применением в различных отраслях науки и промышленности.
Видео:Химия 8 класс (Урок№15 - Оксиды: классификация, номенклатура.)Скачать

Функции оксидов
Одна из основных функций оксидов — это их использование в качестве окислителей. Большинство оксидов способны отдавать кислородные атомы или принимать электроны, что позволяет им проводить окислительно-восстановительные реакции. Это делает оксиды основными компонентами процессов сгорания, окисления и деградации органических и неорганических веществ.
Другая важная функция оксидов — это их использование в качестве пигментов или красителей. Многие оксиды обладают яркими цветами, благодаря чему они широко применяются в производстве красок, косметических продуктов, керамики и стекла.
Оксиды также играют важную роль в процессах каталитической активности. Многие оксиды являются активными катализаторами в различных химических реакциях, таких как синтез аммиака, окисление веществ, гидрирование органических соединений и т.д. Использование оксидов в качестве катализаторов позволяет увеличить скорость реакции и улучшить селективность продуктов.
Другие функции оксидов включают использование их в производстве стекла и керамики (оксид кремния), использование в качестве абразивных материалов (оксид алюминия), применение в электронике и полупроводниковой промышленности (оксиды металлов), использование в качестве консервантов и антисептиков (например, перекись водорода), и т.д.
Таким образом, оксиды являются многофункциональными соединениями, которые выполняют различные функции в разных областях науки и промышленности. Их широкое применение связано с их физическими и химическими свойствами, которые позволяют им быть эффективными в различных процессах.
Видео:Типы оксидов за 2 минуты (8 классам)Скачать
Роль оксидов в природе
Одной из важнейших функций оксидов является регуляция кислотно-щелочного баланса в природных системах. Многие оксиды обладают кислотными свойствами и могут реагировать с основаниями, образуя соли и воду. Именно благодаря этим реакциям оксиды играют важную роль в поддержании стабильности окружающих сред и поддержании оптимальных условий для жизни организмов.
Оксиды также выполняют роль катализаторов во многих биологических и химических процессах. Они могут воздействовать на скорость химических реакций, ускоряя или замедляя их протекание. Некоторые оксиды также обладают фотокаталитическими свойствами, что означает, что они могут провоцировать фотохимические реакции под воздействием света. Такие свойства оксидов часто используются в технологических процессах и в производстве различных материалов.
Некоторые оксиды, такие как оксиды азота и серы, имеют важное значение для климата и экологии. Они участвуют в химических реакциях, приводящих к образованию и разрушению озонового слоя, а также способствуют образованию кислотных осадков. Поэтому их выбросы в атмосферу могут негативно влиять на окружающую среду и здоровье человека.
Оксиды также играют роль в геологических процессах. Некоторые оксиды, такие как оксид железа (ржавчина), образуются при окислительных реакциях с минералами, что может приводить к изменению цвета горных пород и почв. Оксиды также могут быть важными компонентами рудных месторождений, так как они могут содержать ценные металлы.
Таким образом, оксиды играют значительную роль в природе, обеспечивая баланс важных химических процессов, влияя на климатические изменения и геологические процессы.
Видео:Оксиды. Химические свойства. 8 класс.Скачать

Промышленное применение оксидов
Оксиды, как составные элементы многих веществ, широко применяются в промышленности. В зависимости от своих свойств и химического состава, оксиды выполняют различные функции.
Например, оксиды металлов, такие как оксид железа, оксид алюминия и оксид меди, используются в производстве металлургических материалов, керамики и стекла. Оксиды металлов обладают высокой термической и электрической проводимостью, что делает их полезными во многих промышленных процессах.
Другие оксиды, такие как оксид кремния и оксид алюминия, используются в производстве полупроводниковых материалов и электроники. Оксид кремния, который является основным компонентом кремниевых чипов, обладает высокой теплопроводностью и стабильностью, что делает его важным материалом в современной электронике.
Оксиды металлов также используются в производстве красок и пигментов. Например, оксид титана часто используется в производстве белых красок и пластиков. Оксиды железа, такие как оксид железа(III), широко используются в производстве красок и пигментов различных цветов.
Некоторые оксиды также применяются в качестве катализаторов в промышленных процессах. Например, оксид цинка и оксид титана используются в катализаторах для производства пластмасс, резин и других химических соединений.
Промышленное применение оксидов не ограничивается перечисленными примерами. Оксиды играют важную роль во многих отраслях промышленности, от металлургии до электроники, от красок до катализаторов. Для эффективного использования этих веществ в производстве необходимо глубокое понимание их свойств и возможностей.
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Влияние оксидов на окружающую среду
Оксиды, входящие в состав различных материалов и веществ, могут оказывать значительное влияние на окружающую среду и природные экосистемы. Их выбросы в атмосферу, воду или почву могут вызывать серьезные проблемы для окружающей среды и здоровья людей.
Одним из наиболее распространенных оксидов, имеющих негативное влияние на окружающую среду, является диоксид серы (SO2). Он образуется при сжигании ископаемого топлива, такого как уголь или нефть, а также в результате промышленных процессов. Диоксид серы может приводить к образованию кислотных дождей, загрязнению воздуха и почвы, а также негативно влиять на здоровье человека, вызывая заболевания дыхательных путей и аллергические реакции.
Другой вредный оксид – диоксид азота (NO2). Он также образуется при сжигании топлива и в промышленных процессах. Диоксид азота является одним из главных причин образования смога и загрязнения воздуха в больших городах. Он может приводить к проблемам с дыхательной системой, а также является важной составляющей парникового эффекта и изменения климата.
Кроме того, оксиды металлов, такие как оксиды свинца (PbO) и ртути (HgO), являются ядовитыми веществами, оказывающими вредное влияние на живые организмы. Они могут накапливаться в почве, воде и растениях, что может привести к отравлению и нарушению биологического равновесия в экосистемах.
Таким образом, оксиды играют важную роль в формировании и развитии проблем окружающей среды. Для снижения их негативного влияния необходимо принимать меры по сокращению выбросов оксидов в атмосферу, использованию более экологически чистых технологий и внедрению эффективных систем очистки выбросов вредных веществ.
🎦 Видео
Оксиды Состав Номенклатура КлассификацияСкачать

68 учеников этого НЕ ЗНАЮТ! Таблица Менделеева — Как пользоваться?Скачать

Составление формулы оксидов. ПримерСкачать

Оксиды. 1 часть. 8 класс.Скачать
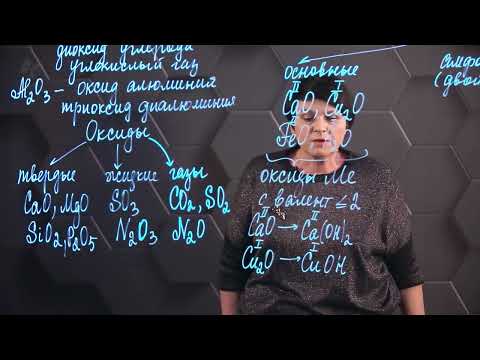
Оксиды. Часть 1: состав, номенклатура, классификация, строениеСкачать

СТРОЕНИЕ АТОМА ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

СВОЙСТВА ОСНОВНЫХ ОКСИДОВ для ЕГЭ по химии | Химический сериал, 1 выпускСкачать

Важнейшие классы неорганических соединений. Тема 9. Состав и классификация оксидовСкачать

45. Химические свойства оксидов. (часть 1)Скачать

Строение атома. Как составить электронную и электронно-графическую формулы?Скачать

Оксиды | Химия ЦТ, ЕГЭСкачать
