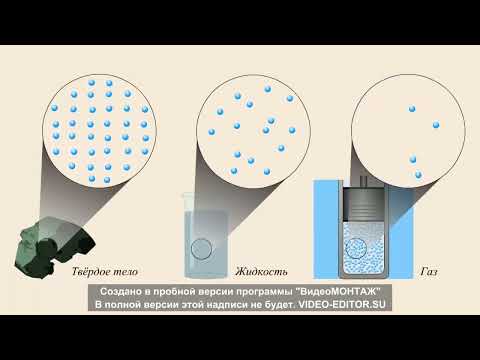
Молекула воды – уникальная вещество, которое присутствует в трех агрегатных состояниях: жидком, твердом и газообразном. Все эти состояния обусловлены особыми силами, действующими между молекулами воды.
Структура молекулы воды во многом определяет ее физические и химические свойства. Каждая молекула воды состоит из двух атомов водорода и одного атома кислорода, соединенных ковалентной связью. Уникальность состоит в том, что между атомами водорода и кислорода имеются около 104,5 градусов угла, образуя форму «угловатого ключа».
В ледяной форме молекулы воды образуют кристаллическую решетку, в которой они упорядочены. Каждая молекула воды связана со своими соседними молекулами при помощи связей водородной. В результате такого упорядочения, лед обладает определенными структурными свойствами и имеет меньшую плотность по сравнению с жидкой водой. Это объясняет, почему лед «плавает» на воде.
В паровой фазе молекулы воды движутся более свободно и они, в основном, не связаны друг с другом. Молекулы пара обладают большей энергией, чем вода в жидкой или твердой форме. Если дать им достаточно энергии, они могут разорвать связи и перейти в газообразное состояние.
Видео:Агрегатные состояния вещества. Расположение молекул воды в разных агрегатных состояниях.Скачать
Структура молекулы воды
Ковалентные связи в молекуле воды образуются путем обмена электронами между атомами. Атом кислорода имеет более высокую электроотрицательность, поэтому он притягивает электроны к себе сильнее, создавая частично отрицательно заряженный центр молекулы. В то же время, атомы водорода становятся частично положительно заряженными.
Из-за электрического притяжения между частично заряженными атомами водорода и частично отрицательно заряженным атомом кислорода, молекулы воды образуют слабые межмолекулярные водородные связи. Эти водородные связи являются причиной многих уникальных свойств воды, таких как ее высокая теплопроводность, поверхностное натяжение и различные фазовые переходы.
Общая структура молекулы воды может меняться в зависимости от условий окружающей среды. При низких температурах вода может образовывать кристаллическую структуру, известную как лед, где молекулы воды расположены в регулярной сетке. При повышении температуры молекулы воды начинают двигаться более активно и переходят в состояние пара, где они расположены в виде дискретных молекул, свободно перемещающихся в пространстве.
Структура молекулы воды играет важную роль в ее химических и физических свойствах, а также в ее способности взаимодействовать с другими веществами. Изучение структуры молекулы воды позволяет лучше понять ее химическую природу и использовать ее в различных областях науки и техники.
Ковалентная связь в молекуле
Ковалентная связь в молекуле воды образуется, когда два атома водорода, каждый с одним электроном, образуют с атомом кислорода, у которого внешний энергетический уровень содержит шесть электронов, общую пару электронов. Такая связь обусловливает структуру молекулы воды, в которой один атом кислорода соединен с двумя атомами водорода углеводородными связями, образуя угол около 104,5 градусов.
Ковалентная связь в молекуле воды обладает прочностью и устойчивостью. Она позволяет молекуле воды образовывать особую структуру при низких температурах – лед. В леде молекулы воды организованы в трехмерную решетку, где каждая молекула воды связана с четырьмя другими молекулами воды по ковалентным связям. Эта структура обеспечивает леду своеобразные физические свойства.
Ковалентная связь в молекуле воды также определяет ее способность образовывать пар при нагревании. Когда температура достигает точки кипения, молекулы воды начинают двигаться достаточно быстро, чтобы нарушить связи и превратиться в пар. При этом ковалентные связи не разрываются, так как требуется значительно большая энергия для их разрушения.
Полярность молекулы
В молекуле воды имеются два водородных атома и один атом кислорода. Атом кислорода обладает более высокой электроотрицательностью по сравнению с атомами водорода. Это означает, что атом кислорода сильнее притягивает электроны, образуя более плотное электронное облако вокруг себя. В результате, атом кислорода приобретает отрицательный заряд, а атомы водорода — положительный заряд.
| Атом | Заряд |
|---|---|
| Кислород | Отрицательный |
| Водород | Положительный |
Данное неравномерное распределение зарядов приводит к наличию диполя, то есть электрического и магнитного поля вокруг молекулы воды. Из-за полярности молекулы воды возникают специфические физические и химические свойства данного вещества, такие как способность к образованию водородных связей и высокая температура плавления и кипения.
Видео:Строение молекулы водыСкачать

Структура леда
Каждая молекула воды в льде соединена с другими молекулами воды через водородные связи. Эти связи образуются между атомом кислорода одной молекулы и атомами водорода других молекул. Из-за того, что водородные связи являются довольно сильными, кристаллическая решетка льда имеет устойчивую структуру.
Структура леда обладает определенной симметрией и регулярностью. Кристаллическая решетка льда имеет гексагональную форму, где каждый атом кислорода окружен шестью атомами водорода. Данная структура создает определенное пространственное расположение молекул воды, что придает льду особые физические свойства.
Интересный факт: Благодаря своей структуре, лед имеет меньшую плотность, чем вода. Поэтому лед плавает на поверхности воды и играет важную роль в биологическом и климатическом смысле.
Сетка молекул льда
Молекулы воды в льде образуют упорядоченную трехмерную структуру, известную как сетка льда. Вода в жидком состоянии имеет случайное расположение молекул, но при охлаждении до температуры ниже 0°C она начинает образовывать регулярную решетку.
Вода находится в ледяных кристаллах, которые состоят из множества молекул воды, связанных друг с другом через водородные связи. Каждая молекула воды образует четыре связи: две прямые и две косые. Прямые связи образуются между кислородом одной молекулы и водородом другой молекулы. Косые связи образуются между водородом одной молекулы и кислородом другой молекулы.
В результате такого аморфного расположения молекул образуется трехмерная решетка льда, в которой каждая молекула воды окружена четырьмя другими молекулами. Сетка льда содержит поры и каналы, которые могут быть заполнены газами или другими молекулами. Это делает лед прекрасным хранилищем для молекул и газов, а также способствует его использованию в различных процессах.
Взаимное расположение молекул льда
Структура льда включает в себя регулярное трехмерное упорядочение молекул воды. Каждая молекула образует связи с четырьмя соседними молекулами, образуя так называемую решетку льда. Эти связи состоят из водородных связей, которые формируются между атомами водорода одной молекулы и атомами кислорода соседних молекул.
Решетка льда обладает определенным симметричным порядком, что обуславливает регулярность его кристаллической структуры. Молекулы воды в льду формируют шестиугольные кольца, в центре каждого из которых находится атом кислорода. Вся структура льда состоит из упорядоченной последовательности таких кольцевых образований, которые соединяются в трехмерную решетку.
Взаимное расположение молекул льда обусловливает его определенные физические и химические свойства. Например, наличие водородных связей между молекулами воды делает лед твердым и прочным материалом. Кроме того, структура льда позволяет ему иметь меньшую плотность по сравнению с жидкой водой, что определяет его способность плавать на поверхности воды.
Видео:Структура водыСкачать

Структура пара
Молекулы воды в паре не имеют фиксированной структуры, как в леду или в жидкой воде. Благодаря высокой энергии молекул пара, они находятся в постоянном движении и меняют свою ориентацию и расстояние между собой.
В паре отсутствуют длинные связи между молекулами, характерные для льда. Вместо этого, молекулы пара находятся на расстоянии друг от друга и могут двигаться независимо друг от друга. Это позволяет им легко перемещаться в пространстве и заполнять имеющийся объем.
Структура пара также зависит от условий, в которых она образуется. При повышении температуры пара становится более разреженной, а молекулы расходятся друг от друга. При низкой температуре и давлении пара может образовывать кристаллическую структуру, но она будет менее упорядоченной, чем в льде.
Структура пара также может быть влияние внешних факторов, таких как давление и наличие других веществ. Например, при нагревании воды в закрытой емкости, пара создает давление внутри и формирует равновесное состояние с жидкой водой.
В целом, структура пара является более хаотичной и менее упорядоченной, чем вода в ледяной или жидкой форме, но все же включает в себя взаимодействия между молекулами, обеспечивающие ее свойства и поведение.
Разделение на отдельные молекулы
Структура молекулы воды может быть изменена в зависимости от условий окружающей среды. В жидком состоянии молекулы воды находятся близко друг к другу и образуют связи водорода между собой. Однако при нагревании или испарении, эти связи становятся менее прочными, и молекулы начинают отделяться друг от друга.
В паре молекулы воды находятся на большом расстоянии друг от друга, и связи водорода между ними прерываются. Такая структура позволяет воде переходить в газообразное состояние при определенных условиях, например при достижении определенной температуры и давления.
В ледяной структуре молекулы воды формируют кристаллическую решетку. Каждая молекула воды соединена с четырьмя соседними молекулами посредством связей водорода. Такая связь позволяет воде образовывать стабильную кристаллическую структуру при низкой температуре.
Разделение на отдельные молекулы играет важную роль в понимании свойств воды и ее агрегатных состояний. Это также имеет значимое влияние на такие процессы, как кипение и выпаривание воды при нагревании, а также сублимация льда при определенных условиях.
Упорядоченность пара
Пар воды представляет собой газообразное состояние данного вещества, при котором молекулы располагаются в противоположных друг другу концах одной линии. Такая упорядоченность основана на водородных связях, которые формируются между молекулами.
В процессе испарения воды, молекулы разбегаются, однако сохраняют связи друг с другом. В результате этого образуется слабая структура, состоящая из молекул воды, связанных между собой водородными связями.
Пар воды является прозрачным и безцветным газом. Однако, при низких температурах, пар может стать видимым в виде тумана или облаков. Величина упорядоченности пара зависит от многих факторов, таких как давление и температура.
| Параментры | Упорядоченность пара |
|---|---|
| Высокое давление, низкая температура | Высокая упорядоченность. Молекулы воды располагаются вблизи друг друга, формируя структуры собранных молекул. |
| Низкое давление, высокая температура | Низкая упорядоченность. Молекулы воды разбегаются, пролетая мимо друг друга с высокой скоростью. |
Упорядоченность пара влияет на его свойства и характеристики. Например, пар с высокой упорядоченностью имеет более высокую плотность и вязкость, чем пар с низкой упорядоченностью.
🎦 Видео
Мультфильм "Секреты воды"Скачать

молекулы воды для МилыСкачать

Что же такое ВОДА на самом деле? | DeeaFilmСкачать

Структура воды, наши слова и мыслиСкачать

Про круговорот воды в природе. Познавательный мультикСкачать

Молекула водыСкачать

Агрегатные состояния вещества | Физика 7 класс #7 | ИнфоурокСкачать

Аномальные свойства водыСкачать

Физика водыСкачать

Агрегатные состояния наглядно (переход лёд-вода и вода-пар)Скачать

Вода и её свойства. Изучаем свойства вода. Пальчиковая гимнастика. Занятие для детей. Эксперименты.Скачать

Урок 187. Испарение и конденсация. Насыщенный пар и его свойстваСкачать

Орбитальная модель молекулы водыСкачать

Три состояния веществаСкачать

Физика 7 класс (Урок№6 - Агрегатные состояния вещества. Обобщение темы «Строение вещества»)Скачать

ПОЧЕМУ ВОДЫ ТАК МНОГО? КАК ВОДА ПОПАЛА НА ЗЕМЛЮ? / Редакция.НаукаСкачать

Агрегатные состояния, фазовые переходы 8 класс, физикаСкачать
