Водород — самый простой и наименее тяжелый химический элемент в таблице Менделеева. Он состоит из одного протона в ядре и одного электрона в облаке электронов, которое окружает ядро.
Протон, являющийся положительно заряженной частицей, имеет массу, примерно равную массе электрона, но наибольшую плотность заряда среди всех известных элементарных частиц. Таким образом, ядро водорода состоит всего из одной частицы — протона.
Электрон обладает отрицательным зарядом и массой, пренебрежимо малой по сравнению с массой протона. Он движется по орбитам вблизи ядра. Конкретная орбита, на которой находится электрон, зависит от его энергии. Энергия электрона влияет на его поведение и химические свойства атома водорода.
Структура атома водорода играет важную роль во многих физических и химических процессах. Это самый простой атом, поэтому его изучение помогает улучшить наше понимание более сложных атомов и их взаимодействий.
- Структура атома водорода
- Состав атома водорода
- Протоны
- Электроны
- Взаимодействие составляющих частей
- Электромагнитное притяжение
- Кулоновское отталкивание
- Атомные орбитали
- Основные орбитали
- Формирование молекулы
- Квантовая механика
- Энергетические уровни
- Спин
- Взаимодействие с электромагнитным полем
- Излучение и поглощение энергии
- 💡 Видео
Видео:СТРОЕНИЕ АТОМА ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Структура атома водорода
Атом водорода состоит из одного протона, который находится в центре и называется ядром атома. Вокруг ядра движется один электрон, образуя электронную оболочку.
Электрон слабо связан с ядром и может двигаться по разным орбитам или энергетическим уровням, которые обозначаются числами. Ближайший к ядру энергетический уровень имеет наименьшую энергию.
Структура атома водорода влияет на его реактивность и химические свойства. Энергетические уровни определяют возможность электрона переходить от одной орбиты к другой и образовывать химические связи с другими атомами.
Важно отметить, что электрон может находиться в определенном энергетическом состоянии или иметь определенное значение энергии. Это состояние может изменяться при взаимодействии атома водорода с внешними факторами, такими как теплота или свет.
Структура атома водорода является основой для понимания структуры других атомов и молекул в химии и физике.
Видео:Энергетические уровни атома (видео 6) | Квантовая физика | ФизикаСкачать

Состав атома водорода
Протон, являющийся основным составляющим атома водорода, имеет массу примерно равную единице атомной массы и обозначается символом «p». Помимо этого, атом водорода также содержит один электрон. Электрон имеет существенно меньшую массу, приблизительно 1/1836 от массы протона, и обозначается символом «e».
Состав атома водорода позволяет ему обладать множеством уникальных свойств и использоваться в различных областях науки и технологии. Взаимодействие протона и электрона определяет энергетические уровни атома, его способность к образованию химических связей и участие в различных химических реакциях.
| Состав атома водорода | Заряд | Масса (атомные единицы) |
|---|---|---|
| Протон (p) | +1 | 1 |
| Электрон (e) | -1 | 1/1836 |
Состав атома водорода играет ключевую роль в физике и химии, а также является отправной точкой для изучения более сложных атомов и молекул. Кроме того, на основе понимания структуры атома водорода были разработаны различные модели атома, которые помогли установить общие принципы устройства вещества.
Протоны
Протоны играют важную роль в структуре атома водорода и влияют на его свойства и химические реакции. Количество протонов в атоме определяет его атомный номер и определяет его химические свойства. Кроме того, протоны взаимодействуют с электронами, что приводит к образованию электростатических сил и удержанию электронов вблизи ядра атома.
Электроны
Расположение электронов в атоме определяется энергетическим уровнем. Электроны могут находиться на различных энергетических уровнях, которые характеризуются главными квантовыми числами. Чем дальше энергетический уровень от ядра, тем выше энергия электронов.
На энергетических уровнях могут находиться подуровни, которые характеризуются вторичными квантовыми числами. Подуровни разделяются на субуровни, которые могут содержать до двух электронов.
По принципу заполнения, электроны в атоме водорода заполняют энергетические уровни начиная с низших. Электроны находятся в основном состоянии, когда все энергетические уровни заполнены полностью или частично.
Электроны в атоме водорода играют важную роль в химических реакциях и взаимодействиях с другими атомами. Их расположение и количество влияют на физические и химические свойства вещества, такие как проводимость, плотность, теплопроводность и т. д.
Видео:Лучшая модель атома? [Минутка физики]Скачать
![Лучшая модель атома? [Минутка физики]](https://i.ytimg.com/vi/eybcxXiYJfc/0.jpg)
Взаимодействие составляющих частей
Взаимодействие между протоном и электроном определяет структуру атома водорода. Протон, находящийся в центре атома и обладающий положительным зарядом, притягивает электрон, находящийся на определенной орбите, своим электрическим полем. Этот электрон движется по орбите вокруг протона, создавая стационарную систему.
Орбита электрона имеет форму сферы, но точная форма орбиты не определена, так как она зависит от вероятностей нахождения электрона в разных точках пространства. Электрон может находиться в определенных областях пространства, но его точное положение нельзя точно определить.
Таким образом, взаимодействие между электроном и протоном определяет структуру атома водорода и его энергетические уровни. Как изменение расстояния между электроном и протоном, так и изменение энергии системы могут привести к изменению структуры атома и его свойств.
Электромагнитное притяжение
Атом водорода состоит из одного протона в ядре и одного электрона, движущегося по орбите вокруг ядра. Взаимодействие между этими частицами происходит в основном благодаря электромагнитному притяжению.
Электромагнитное притяжение – это сила притяжения между электрически заряженными частицами. Протон имеет положительный электрический заряд, а электрон имеет отрицательный заряд. Поэтому электрон притягивается к протону благодаря силе электростатического притяжения.
Однако, электромагнитное притяжение между электроном и протоном сопровождается тонкими эффектами, такими как квантовая механика. В связи с этим, орбита электрона представляет собой область, в которой существует вероятность найти электрон. Это означает, что электрон не движется по строго определенной орбите, а находится во всех местах с определенной вероятностью.
Кроме того, электроны обладают свойством спина, который мы можем описать как магнитный момент частицы. Это означает, что электроны также взаимодействуют с магнитным полем, создаваемым протоном в ядре. Это магнитное взаимодействие также влияет на поведение электронов в атоме водорода.
Таким образом, электромагнитное притяжение является основным фактором, определяющим структуру и поведение атома водорода. Оно обусловливает силу притяжения между протоном и электроном, а также влияет на квантовые свойства и магнитное поведение электронов.
Кулоновское отталкивание
В случае атома водорода, сила кулоновского отталкивания между электроном и ядром направлена от ядра к электрону. Однако, эта сила компенсируется центробежной силой, возникающей из-за вращения электрона вокруг ядра. Это позволяет электрону оставаться на своей орбите и не падать на ядро. Таким образом, кулоновское отталкивание между электроном и ядром определяет структуру атома водорода и его физические свойства.
Видео:Спектр излучения водорода (видео 12) | Квантовая физика | ФизикаСкачать
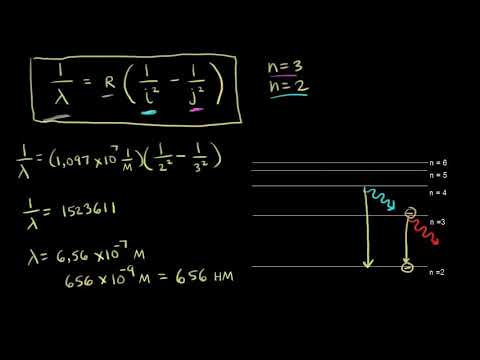
Атомные орбитали
Орбитали делятся на несколько типов в зависимости от формы и энергии. Основные типы орбиталей — s, p, d, f. Орбитали типа s имеют сферическую форму и наименьшую энергию. Орбитали типа p имеют форму шара с плоскостными областями вокруг него и немного большую энергию, чем орбитали типа s. Орбитали типа d имеют сложную форму и еще большую энергию, а орбитали типа f имеют форму сферы с дополнительными сложными областями и самую высокую энергию.
Каждый тип орбиталей может содержать определенное количество электронов. Орбитали типа s могут содержать до 2 электронов, орбитали типа p — до 6 электронов, орбитали типа d — до 10 электронов, а орбитали типа f — до 14 электронов. Количество электронов в каждом типе орбиталей определяет электронную конфигурацию атома и его химические свойства.
Атомные орбитали также влияют на спектральные свойства атома. При переходе электронов между разными энергетическими уровнями происходит поглощение или испускание энергии в виде электромагнитного излучения. Каждый тип орбиталей имеет свой характерный спектральный отпечаток, который может быть использован для идентификации элемента или оценки его состояния.
Основные орбитали
Основные орбитали атома водорода образуются из комбинации трех главных квантовых чисел: главного квантового числа (n), орбитального квантового числа (l) и магнитного квантового числа (m).
Главное квантовое число (n) определяет основной энергетический уровень орбитали. Оно может принимать значения от 1 до бесконечности. Чем больше значение n, тем выше энергетический уровень и больше радиус орбитали.
Орбитальное квантовое число (l) определяет форму орбитали. Оно может принимать значения от 0 до n-1. Например, для основной орбитали с n=1, значение l равно 0 и она представляет сферическую форму.
Магнитное квантовое число (m) определяет ориентацию орбитали в пространстве. Оно может принимать значения от -l до l. Например, для основной орбитали с l=0, значение m равно 0 и она не имеет определенной ориентации.
Основные орбитали водорода включают семь типов: s, p, d, f, g, h и i. Каждая основная орбиталь имеет свою форму и структуру. Например, s-орбиталь имеет сферическую симметрию, а p-орбиталь имеет две симметричные полусферы.
Основные орбитали влияют на химические свойства атома водорода, такие как его энергия и реакционная активность. Взаимодействие основных орбиталей с другими атомами и молекулами определяет химические связи и структуру соединений.
Изучение основных орбиталей атома водорода помогает понять его строение и поведение, а также применять эту информацию в химических и физических исследованиях.
Формирование молекулы
Формирование молекулы водорода происходит при объединении двух атомов водорода. Каждый атом водорода имеет один электрон в оболочке, который принадлежит внешней s-орбитали. При сближении двух атомов водорода их электроны начинают взаимодействовать друг с другом, образуя силу притяжения их положительных ядер с отрицательно заряженными электронами.
В результате такого взаимодействия образуется химическая связь, которая держит атомы вместе и формирует молекулу водорода. При этом оба атома становятся нейтральными, так как их положительные и отрицательные заряды компенсируют друг друга.
Формирование молекулы водорода происходит согласно правилам квантовой механики. В соответствии с этими правилами, электроны занимают определенные энергетические уровни вокруг ядра. Первый уровень может вместить максимум два электрона, а второй уровень — максимум восемь электронов.
| Характеристика | Атом 1 | Атом 2 |
|---|---|---|
| Количество электронов | 1 | 1 |
| Энергетический уровень | 1 | 1 |
Таким образом, молекула водорода состоит из двух атомов, каждый из которых имеет один электрон и находится на первом энергетическом уровне. Оба атома водорода связаны с помощью химической связи, которая образуется из-за взаимодействия их электронов.
Формирование молекулы может происходить также при соединении атомов других химических элементов. В зависимости от количества электронов в оболочке атома и его энергетического уровня, свойства молекулы и химические связи в ней могут значительно отличаться. Однако принцип образования молекулы сохраняется — атомы соединяются с помощью химических связей и образуют молекулярную структуру вещества.
Видео:Видеоролик - анимация "Строение атома и ядра"Скачать

Квантовая механика
Квантовая механика основана на принципах, которые разительно отличаются от классической механики. Например, в классической механике предполагается, что частицы могут иметь любые значения энергии, скорости и положения. В квантовой механике, однако, эти величины дискретны и имеют определенные значения.
Квантовая механика важна для понимания строения атома водорода, так как атомы водорода являются простейшими системами, состоящими из одной электронной оболочки и ядра. В квантовой механике описываются энергетические уровни электрона в атоме водорода, а также вероятности нахождения электрона в различных областях вокруг ядра.
Основные понятия квантовой механики, такие как волновая функция и состояние системы, позволяют точно описывать поведение частиц в микромире. Квантовая механика также является основой для многих других физических теорий и применяется в различных областях, таких как квантовая оптика, квантовая химия и квантовая информатика.
Энергетические уровни
Атом водорода имеет дискретные энергетические уровни, на которых находятся электроны. Каждый уровень соответствует определенной энергии, и электроны находятся на уровнях с наименьшей энергией в своем основном состоянии.
Уровни энергии обозначаются целыми числами, начиная с 1 для основного уровня. Каждый следующий уровень имеет большую энергию и обозначается числом 2, 3, 4 и так далее.
Переход электрона с одного уровня на другой происходит при поглощении или испускании фотона, энергия которого равна разности энергий между двумя уровнями. Это явление называется переходом между энергетическими уровнями и определяет спектральные линии, наблюдаемые в спектре атома водорода.
На энергетические уровни влияют такие факторы, как внешнее электрическое поле или магнитное поле. Эти внешние воздействия могут вызвать смещение или расщепление энергетических уровней, что влияет на поведение электронов в атоме.
Спин
Спин может быть представлен в виде вращения частицы вокруг своей оси и определяет ее ориентацию. Он может принимать только определенные значения, которые выражаются в единицах, называемых магнитными квантовыми числами. Эти значения описывают, как спин взаимодействует с магнитными полями.
Спин важен для понимания различных физических процессов, так как он влияет на взаимодействие частицы с электромагнитным полем. Он также играет ключевую роль в определении энергетических уровней и разрешенных состояний атома водорода.
Изучение спина помогает углубить понимание квантовой механики и свойств атомов и молекул. Исследования в этой области продолжаются, и новые открытия влияют на различные области физики и технологий.
Видео:Урок 447. Модель атома водорода по БоруСкачать

Взаимодействие с электромагнитным полем
Когда электрон переходит с более высокого энергетического уровня на более низкий, он испускает фотон света определенной длины волны, которая зависит от разности энергии между двумя уровнями. Это явление называется испускательной способностью атома водорода и объясняет почему атомы водорода могут быть источником света в видимом диапазоне спектра.
Обратный процесс, абсорбция света, происходит, когда электрон поглощает фотон с энергией, соответствующей энергетическому разрыву между двумя уровнями. Это может произойти, когда атом водорода находится в области электромагнитного поля с определенной частотой.
Интенсивность взаимодействия атома водорода с электромагнитным полем также зависит от поляризации поля. Атом водорода может изменять свое энергетическое состояние, взаимодействуя с поляризованным электромагнитным полем, что важно для таких явлений, как электромагнитная спектроскопия и оптическая поляризация.
Излучение и поглощение энергии
Структура атома водорода обладает особыми свойствами в отношении процессов излучения и поглощения энергии. Атом водорода состоит из одного электрона, который обращается по орбите вокруг ядра, состоящего из одного протона.
Когда атом водорода поглощает энергию в форме света или других электромагнитных волн, электрон может перейти на более удаленную орбиту, такую как высший энергетический уровень. Переход электрона с более низкой орбиты на более высокую сопровождается поглощением энергии.
Излучение энергии происходит, когда электрон в атоме водорода переходит с более высокой энергетической орбиты на более низкую. При этом энергия уносится в виде электромагнитных волн различных частот и длин волн. Каждый переход электрона относится к определенной длине волны излучаемого света, которая может быть определена с помощью формулы Бальмера.
Энергия излучения и поглощения атомом водорода зависит от разницы энергетических уровней электрона. Чем больше разница между орбитами, на которые может перейти электрон, тем больше энергии будет поглощено или излучено. Это объясняется формулой Ридберга, которая позволяет рассчитать энергию перехода электрона.
| Орбита | Энергия |
|---|---|
| 1 | -13.6 эВ |
| 2 | -3.4 эВ |
| 3 | -1.51 эВ |
| 4 | -0.85 эВ |
Таблица показывает энергетические уровни орбит электрона в атоме водорода и энергию, связанную с каждой орбитой. Между разными орбитами имеется разница энергии, что определяет частоту излучаемого или поглощаемого света.
Излучение и поглощение энергии в атоме водорода играют важную роль в различных физических и химических процессах. Эти процессы являются основой многих научных и инженерных приложений, а также позволяют углубить наше понимание строения атома и физических законов, регулирующих его поведение.
💡 Видео
Состав и строение атома. Изотопы. 7 класс.Скачать

АТОМ ВОДОРОДА УМЕНЬШИЛСЯ. Что это значит для нас?Скачать

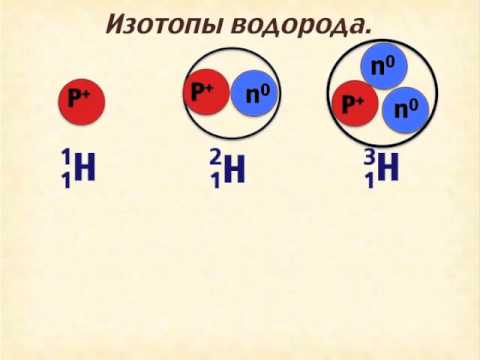
Изотопы водородаСкачать
Квантовые постулаты Бора. Модель атома | Физика 11 класс #43 | ИнфоурокСкачать

Урок 445. Особенности спектра атома водорода. Диаграмма ГротрианаСкачать
💢 Иванов И. Удивительный Мир внутри Атомного Ядра. Full Video ReMastered.Скачать

Урок 459. Обзор квантовой теории атома водородаСкачать

Строение атомного ядра. Ядерные силыСкачать

Природа линейчатых спектров атома водорода по Бору, 1976Скачать

Строение атома. Как составить электронную и электронно-графическую формулы?Скачать

8 класс. Распределение электронов в атоме. Электронные формулы.Скачать

Квантовые числа (видео 14) | Квантовая физика | ФизикаСкачать

Урок 138 (осн). Строение атомаСкачать

БЕЗ ЭТОГО НЕ СДАТЬ ЕГЭ по Химии — Электронная конфигурация атомаСкачать
