Вещество — это материальная субстанция, состоящая из атомов, молекул или ионов, которые обладают определенными физическими и химическими свойствами. Каждое вещество имеет свою химическую формулу, и его состав зависит от типа и количества атомов, из которых оно состоит.
Простое вещество — это вещество, состоящее из атомов одного и того же химического элемента. Основная единица простого вещества — это атом, который не может быть разделен на более простые компоненты без изменения его химических свойств. Простые вещества могут быть представлены в различных агрегатных состояниях — газообразном, жидком или твердом.
Каждый химический элемент имеет уникальные свойства, определяемые его атомной структурой. Например, атомы кислорода (O) образуют соединения, имеющие кислотные свойства, в то время как атомы натрия (Na) образуют щелочные соединения. Простые вещества можно использовать как ингредиенты для создания сложных соединений или в качестве отдельных веществ в природной форме, например, кислород в атмосфере или золото в виде самородков.
- Атомы и молекулы
- Структура атома
- Образование молекул
- Химические элементы
- Общие свойства химических элементов
- Периодическая система химических элементов
- Простые вещества и их свойства
- Понятие о простых веществах
- Физические свойства простых веществ
- Химические свойства простых веществ
- Химический состав простого вещества
- Основные компоненты простых веществ
- Соотношение компонентов в простом веществе
- 📺 Видео
Видео:Химические элементы и их символы. 7 класс.Скачать

Атомы и молекулы
Атомы разных элементов отличаются числом протонов в ядре, что определяет их химические свойства. Например, атом гидрогена содержит один протон, а атом кислорода — восемь протонов.
Молекулы образуются в результате соединения атомов разных элементов. Молекула может состоять из двух или более атомов. Соединение атомов происходит путем обмена или совместного использования электронов.
Молекулы могут быть одноатомными, когда состоят из атомов одного элемента, или многоатомными, когда состоят из атомов нескольких элементов.
С помощью атомов и молекул возможно объяснить множество химических и физических свойств вещества. Изучение структуры и взаимодействия атомов и молекул позволяет нам понять и описать процессы, происходящие в нашем окружении.
Структура атома
Ядро — это центральная часть атома, которая содержит протоны и нейтроны. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Масса ядра сосредоточена преимущественно в протонах и нейтронах, поэтому ядро является самой тяжелой частью атома.
Электронная оболочка — это область вокруг ядра, в которой находятся электроны. Электроны имеют отрицательный заряд и обращаются по определенным орбитам или энергетическим уровням. Количество электронов в оболочке зависит от атомного номера элемента. Электронная оболочка устойчива и разделена на несколько подуровней и орбиталей.
Структура атома определяет его свойства и взаимодействие с другими веществами. Понимание структуры атома позволяет предсказывать химические реакции и создавать новые материалы с различными свойствами.
Образование молекул
Простое вещество состоит из атомов, которые могут объединяться друг с другом и образовывать молекулы. Молекула состоит из двух или более атомов, которые связаны между собой химическими связями.
Образование молекул происходит благодаря химическим реакциям, в которых происходит перераспределение электронов между атомами. Электроны играют важную роль в образовании молекул, так как они определяют свойства вещества.
При образовании молекулы каждый атом старается достичь стабильного электронного строения. Он может делиться своими электронами с другими атомами или принимать электроны от других атомов. Таким образом, образуется химическая связь между атомами в молекуле.
Молекула может содержать атомы одного или разных элементов. В зависимости от количества атомов, молекула может быть мономером (состоять из одного атома) или полимером (состоять из множества атомов).
Важно отметить, что образование молекулы может происходить как в реакциях с участием элементов, так и в реакциях с участием соединений. Таким образом, молекулы могут быть образованы из различных химических веществ, что обуславливает огромное разнообразие веществ в природе.
Видео:Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Химические элементы
Периодическая система элементов — таблица, в которой все химические элементы упорядочены по возрастанию атомных номеров. Она показывает строение атомов вещества и предоставляет информацию о их химических и физических свойствах.
Существует 118 известных химических элементов. Они классифицируются по своим химическим свойствам и структуре атомов. Все элементы обозначаются символами, которые часто соответствуют их английским названиям, например, H для водорода и C для углерода.
Химические элементы имеют различные свойства и играют важную роль во многих областях науки и промышленности. Они используются в химических реакциях, создании материалов, производстве электрической энергии и многих других процессах.
Изучение свойств и взаимодействия химических элементов является основой химии и фундаментальной частью нашего понимания мира вокруг нас.
Общие свойства химических элементов
1. Атомный номер — это количество протонов в ядре атома. Он определяет положение элемента в периодической таблице и уникальные свойства элемента. Например, водород имеет атомный номер 1, что делает его самым легким и наиболее распространенным элементом во Вселенной.
2. Атомная масса — это средняя масса атомов элемента, выраженная в атомных единицах. Атомная масса определяется суммой протонов и нейтронов в атоме. Например, атомный номер кислорода равен 8, а его атомная масса равна примерно 16 атомным единицам, что делает его одним из наиболее распространенных элементов на Земле.
3. Электронная конфигурация — это распределение электронов в энергетических уровнях атома. Электроны занимают различные энергетические уровни, называемые оболочками, и подуровни, называемые субоболочками. Электронная конфигурация помогает объяснить физические и химические свойства элементов.
4. Валентность — это число электронов, доступных для участия в химических реакциях. Она определяет, какие атомы способны образовывать химические связи и какие типы связей они могут образовывать. Например, валентность кислорода равна 2, поэтому он может образовывать одну или две связи с другими атомами.
5. Ионизационная энергия — это энергия, необходимая для удаления одного электрона из атома. Чем больше ионизационная энергия, тем сильнее атом удерживает свои электроны и тем менее вероятно, что он будет участвовать в химических реакциях.
6. Электроотрицательность — это способность атома притягивать электроны в химической связи. Чем выше электроотрицательность элемента, тем сильнее он притягивает электроны и тем полярнее становится химическая связь между двумя атомами.
Эти общие свойства химических элементов являются основой для понимания их химического поведения и использования в различных промышленных и научных областях.
Периодическая система химических элементов
Периодическая система включает в себя все известные химические элементы, начиная от водорода (H) и заканчивая оганессоном (Og) — элементом с атомным номером 118. Всего в ПСХЭ представлено 118 элементов, которые организованы в 7 периодов и 18 групп. Некоторые группы имеют свои наименования, такие как щелочные металлы, щелочноземельные металлы, галогены, инертные газы и т.д.
Каждый элемент в ПСХЭ представлен своим символом, который состоит из одной или двух латинских букв. Например, символ водорода — H, кислорода — O, углерода — C и так далее. Кроме того, у каждого элемента есть атомный номер, который определяет его положение в таблице. Атомный номер равен количеству протонов в атоме элемента и является основной характеристикой элемента.
Периодическая система химических элементов является фундаментальной основой для изучения химии. Она помогает классифицировать и систематизировать все известные элементы и предсказывать их свойства на основе их местоположения в таблице. ПСХЭ также является важным инструментом для понимания химических реакций и молекулярной структуры вещества.
| Период | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
|---|---|---|---|---|---|---|---|
| Группа | 1 | 2 | Б | П | Г | Д | Ф |
| 1 | H | He | |||||
| 2 | Li | Be | |||||
| 3 | Na | Mg | |||||
| 4 | K | Ca | |||||
| 5 | Rb | Sr | |||||
| 6 | Cs | Ba | |||||
| 7 | Fr | Ra | |||||
| Группа | 3 | 4 | 5 | 6 | 7 | Е | Ж |
| 3 | Sc | Ti | V | Cr | Mn | ||
| 4 | Y | Zr | Nb | Mo | Tc | ||
| 5 | La | Hf | Ta | W | Re | ||
| 6 | Ac | Rf | Db | Sg | Bh | ||
| 7 | Hs | ||||||
| 8 | Mt | ||||||
| 9 | Ds | ||||||
| 10 | Rg | ||||||
| 11 | Cn | ||||||
| 12 | Zn | Cd | Hg | Cn | Cn | ||
| Период | 8 | 9 | 10 | 11 | 12 |
Таблица представляет собой сокращенную форму ПСХЭ, где указаны только некоторые элементы для наглядности. Для получения полной и подробной информации о химических элементах из ПСХЭ следует обратиться к источникам, где содержится расширенная таблица.
Видео:Состав и строение атома. Изотопы. 7 класс.Скачать

Простые вещества и их свойства
Один из самых известных примеров простых веществ — водород. Водород — легкий газ без цвета, запаха и вкуса. Он является самым обеспеченным элементом во Вселенной и входит в состав воды.
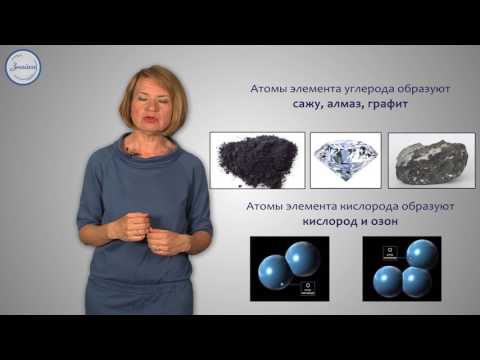
Еще одно простое вещество — кислород. Кислород — это газ без цвета, запаха и вкуса, который составляет около 20% атмосферного воздуха. Кислород является необходимым для дыхания живых организмов и поддержания горения.
Азот — еще одно простое вещество. Азот — безвредный, безцветный газ, который составляет около 78% атмосферного воздуха. Он играет важную роль в биологических процессах и используется в промышленности.
Углерод — простое вещество, имеющее различные формы, включая графит, алмаз и угленный черный. Углерод является основным компонентом органических соединений и имеет множество применений в различных отраслях промышленности.
Фосфор — еще одно простое вещество, которое может существовать в нескольких различных формах. Оно широко используется в химической промышленности и является необходимым для жизни всех живых организмов.
Таким образом, простые вещества имеют разнообразные свойства и играют важную роль во многих аспектах нашей жизни, начиная от свойств воды и воздуха до применения углерода в технологических процессах. Изучение этих веществ и их свойств является важной частью химической науки.
Понятие о простых веществах
На сегодняшний день в таблице элементов Менделеева представлено 118 простых веществ. Они разделены на группы в соответствии с их химическими свойствами и атомными номерами. Группы элементов включают металлы, неметаллы и полуметаллы.
Простые вещества являются строительными блоками всего материального мира. Они обладают разными физическими и химическими свойствами, определяющими их использование в различных областях науки и технологии. Например, металлы используются в строительстве, электронике и промышленности, неметаллы — в химической, пищевой и фармацевтической промышленности.
Понимание простых веществ и их свойств играет важную роль в развитии науки и технологии. Изучение веществ позволяет разрабатывать новые материалы, создавать новые технологии и улучшать качество жизни человека. Поэтому изучение простых веществ имеет большое значение в химии и других научных дисциплинах.
Физические свойства простых веществ
Одним из основных физических свойств простых веществ является точка плавления. Точка плавления – это температура, при которой простое вещество переходит из твердого состояния в жидкое. Например, для железа точка плавления составляет около 1535°C, а для серебра – примерно 961°C.
Еще одним важным физическим свойством простых веществ является точка кипения. Точка кипения – это температура, при которой простое вещество переходит из жидкого состояния в газообразное. Например, для водорода точка кипения составляет около -252.87°C, а для кислорода – приблизительно -182.96°C.
Также простые вещества обладают магнитными свойствами. Они могут быть как магнетиками, то есть обладать способностью притягиваться к магниту, так и немагнитными. Например, железо является магнетиком, а алюминий – немагнитным веществом.
Кроме того, простые вещества могут обладать электрическими свойствами. Они могут быть проводниками, то есть обладать способностью проводить электрический ток, и непроводниками. Например, медь является проводником электричества, а стекло – непроводником.
Таким образом, физические свойства простых веществ представляют собой важные характеристики, позволяющие определять их состояние и взаимодействие с окружающей средой.
Химические свойства простых веществ
Простые вещества обладают своими уникальными химическими свойствами, которые определяются структурой и компонентами этих веществ. В данном разделе мы рассмотрим основные химические свойства простых веществ.
1. Реакция с кислотами: многие простые вещества реагируют с кислотами, образуя соли и выделяя газы. Например, натрий реагирует с соляной кислотой, образуя хлорид натрия и выделяя водородный газ.
2. Реакция с щелочами: некоторые простые вещества реагируют с щелочами, образуя соли и выделяя воду. Например, алюминий реагирует с щелочью натрия, образуя алюминат натрия и выделяя воду.
3. Окислительные свойства: некоторые простые вещества обладают окислительными свойствами, то есть способностью окислять другие вещества. Например, кислород является хорошим окислителем и может образовывать оксиды с другими элементами.
4. Взаимодействие с другими простыми веществами: простые вещества могут реагировать между собой, образуя различные соединения. Например, сера и кислород могут образовывать оксид серы.
5. Восстановительные свойства: некоторые простые вещества обладают восстановительными свойствами, то есть способностью восстанавливать окисленные вещества. Например, водород может восстанавливать окисленные металлы.
6. Реакция с водой: некоторые простые вещества реагируют с водой, образуя оксиды и выделяя газы. Например, литий реагирует с водой, образуя оксид лития и выделяя водородный газ.
Химические свойства простых веществ позволяют нам понять и прогнозировать их реакции и влияние на окружающую среду. Каждое простое вещество имеет свою уникальную комбинацию химических свойств, которые устанавливают его химическую активность и возможность применения в различных отраслях науки и промышленности.
Видео:СТРОЕНИЕ АТОМА ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Химический состав простого вещества
Простое вещество, как правило, состоит из атомов одного элемента. Атомы элементов обладают определенными химическими свойствами и не могут разлагаться на более простые вещества обычными химическими методами.
Химический состав простого вещества определяется его формулой, которая показывает, из каких элементов и в каком количестве состоит данное вещество. Например, вода — это простое вещество, его химическая формула H2O. Формула показывает, что в молекуле воды присутствуют два атома водорода и один атом кислорода.
Простые вещества могут быть представлены в разных агрегатных состояниях — твердом, жидком или газообразном. Некоторые простые вещества имеют металлическую структуру, например, железо или медь, другие — неметаллическую, например, сера или фосфор. Также существуют простые вещества, которые обладают полупроводниковыми свойствами, как, например, кремний или германий.
Химический состав простого вещества имеет огромное значение для изучения и практического применения материалов. Понимание состава позволяет управлять и изменять свойства вещества, делая его полезным для различных областей науки и техники.
Основные компоненты простых веществ
Простые вещества состоят только из одного типа атомов и не могут быть разложены на более простые вещества путем химических реакций. Всего существует около 90 различных простых веществ, состоящих из разных элементов.
Каждый элемент имеет свой уникальный химический символ, который используется для его обозначения. Химические символы обычно состоят из одной или двух латинских букв, которые могут быть верхнего или нижнего регистра.
Основные компоненты простых веществ могут быть представлены в виде таблицы, где указывается химический символ элемента и его название. Ниже приведена таблица с несколькими примерами основных компонентов простых веществ:
| Химический символ | Название элемента |
|---|---|
| H | Водород |
| O | Кислород |
| C | Углерод |
| Na | Натрий |
| Cl | Хлор |
Эти примеры представляют лишь малую часть основных компонентов простых веществ. Все они играют важную роль в химических реакциях и имеют различные свойства и химические связи.
Соотношение компонентов в простом веществе
Формула простого вещества составляется из химических символов элементов и указывает какие именно и в каком соотношении атомы присутствуют в данном веществе. Например, формула для воды — H2O — указывает, что воду составляют 2 атома водорода (H) и 1 атом кислорода (O).
Соотношение компонентов в простом веществе может быть выражено в виде мольного соотношения. Мольное соотношение показывает, в каких пропорциях атомы элементов соединяются между собой.
Например, в мольном соотношении для воды указывается, что каждая молекула воды содержит 2 атома водорода и 1 атом кислорода. Такое мольное соотношение можно записать как H2O.
Соотношение компонентов в простом веществе может также быть выражено в виде массового соотношения. Массовое соотношение показывает, сколько граммов каждого элемента содержится в единице вещества.
Например, в массовом соотношении для воды указывается, что 1 моль воды содержит 2 грамма водорода и 16 граммов кислорода. Такое массовое соотношение можно записать как H:O = 2:16, или в упрощенном виде H:O = 1:8.
Соотношение компонентов в простом веществе является важным понятием в химии, так как оно определяет химические свойства и структуру вещества. Изучение соотношения компонентов позволяет понять, какие реакции и связи могут образовываться между атомами вещества.
📺 Видео
Атомы и молекулы. Простые и сложные вещества. 7 класс.Скачать

1 ЗАДАНИЕ: Химический элемент и Простое вещество | Как решать БЕЗ ОШИБОК? | Химия ОГЭСкачать

Определение массовых долей элементов в соединениях. 8 класс.Скачать

Первое задание на ОГЭ по химии | Денис Марков | УмскулСкачать

Химический элемент или простое вещество? | 1 задание ОГЭ химия | XIMOZAСкачать

Воздух. Состав воздуха. 7 класс.Скачать

Характеристика элемента по положению в Периодической системе и строению атома. 1 часть. 8 класс.Скачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Химия 8 класс (Урок№11 - Кислород: получение, физические и химические свойства,применение. Оксиды.)Скачать

Химия 8 класс (Урок№5 - Закон постоянства состава веществ. Химические формулы.)Скачать

ВСЯ ХИМИЯ С НУЛЯ! | Денис Марков | УмскулСкачать

Химия - просто. Урок 1 "ПСЭ"Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химические элементы в организме человека. 7 класс.Скачать

Химия 8 Простые и сложные вещества Состав веществСкачать
Составление уравнений химических реакций. 1 часть. 8 класс.Скачать
