Аммиак — это химическое вещество, которое широко применяется в различных отраслях промышленности и сельского хозяйства. Состоит он из трех основных компонентов: атомов азота и водорода, объединенных в молекулу NH3. Аммиак является безцветным газом с интенсивным запахом, который может вызывать раздражение дыхательных путей и глаз.
Основной источник аммиака — природный азот, содержащийся в атмосферном воздухе. Процесс синтеза аммиака является сложным и требует высоких температур и давления. В промышленности основным методом производства аммиака является габаритный способ Габера-Боша.
Аммиак имеет несколько важных свойств, которые делают его полезным в различных областях. Во-первых, он хорошо растворяется в воде, образуя аммиачный раствор. Это свойство делает аммиак основным компонентом удобрений, используемых для обогащения почвы азотом. Кроме того, аммиачный раствор активно применяется в холодильной промышленности.
Во-вторых, аммиак обладает щелочными свойствами и может реагировать с кислотами, образуя соль и воду. Это свойство используется в химической промышленности для производства различных химических соединений, в том числе удобрений, уксусной кислоты и нитрата аммония.
Кроме того, аммиак является одним из важнейших промышленных химикатов и активно используется в таких отраслях, как производство пластмасс, текстильной и кожевенной промышленности, а также в производстве взрывчатых веществ.
Видео:Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

Структура аммиака и его основные свойства
Структурная формула аммиака показывает, что молекула состоит из одного атома азота (N) и трех атомов водорода (H). Связи между атомами образуют пирамидальную структуру, где атом азота находится в вершине пирамиды, а атомы водорода расположены на ее боках.
Аммиак является амфотерным соединением, то есть обладает свойствами кислоты и основания. Согласно теории Бронстеда-Лоури, аммиак может принимать протон и действовать как основание, образуя ион аммония NH4+. Также аммиак может отдавать протон и выступать в роли кислоты.
Основные свойства аммиака:
| Свойство | Описание |
|---|---|
| Растворимость в воде | Аммиак хорошо растворяется в воде, образуя аммиачные растворы, которые могут быть кислотными или щелочными в зависимости от концентрации аммиака. |
| Реакция с кислотами | Аммиак реагирует с кислотами, образуя соли аммония. Например, соляная кислота (HCl) и аммиак взаимодействуют, образуя хлорид аммония (NH4Cl). |
| Запах | Аммиак обладает специфическим резким запахом, который можно ощутить даже при низких концентрациях в воздухе. |
| Опасность | Аммиак является токсичным газом и может вызвать раздражение глаз, кожи и дыхательных путей при вдыхании или контакте. |
Аммиак широко используется в различных отраслях, включая промышленность, сельское хозяйство и производство химических реактивов. Его применяют в производстве удобрений, холодильных систем, чистящих средств и других продуктов.
Видео:ЭТО НЮХАЛ КАЖДЫЙ. АММИАКСкачать

Какие элементы входят в состав аммиака
Азот (N) — это химический элемент из группы пневмогенов, расположенный в 15-й группе периодической таблицы. Он обладает атомным номером 7 и отличается высокой электроотрицательностью. В аммиаке азот играет ключевую роль в образовании азотистых связей.
Водород (H) — это самый легкий химический элемент, обладающий атомным номером 1. В аммиаке водород обеспечивает реактивность и проявляет себя как донор электронов в химических реакциях.
Смесь азота и водорода в соотношении 1:3 образует аммиак при помощи катализатора.
Аммиак имеет неприятный запах и может быть использован в множестве промышленных и научных приложений, таких как удобрения, производство пластиков, очистка воды и производство холодильного оборудования.
Азот
Азот является неактивным газом, что делает его незаменимым для многих химических процессов. Это одна из основных причин, по которой азот используется в таких отраслях, как сельское хозяйство, производство удобрений, пищевая промышленность и производство взрывчатых веществ.
Свойства азота:
- Азот является газообразным при нормальных условиях температуры и давления.
- Он имеет очень низкую плотность и может быть использован для создания инертной атмосферы.
- Азот является стабильным газом и не горит и не поддерживает горение.
- Он может образовывать соединения с другими элементами, такие как аммиак (NH3) и нитраты (NO3-).
Азот также играет важную роль в экосистемах, так как является необходимым элементом для роста растений. Он может быть фиксирован в почве некоторыми бактериями и осуществлять цикл азота, который позволяет растениям получать необходимые им питательные вещества.
Водород
Водород химически активен и может образовывать соединения с другими элементами. Однако его основным свойством является его газообразное состояние при нормальных условиях. Водород не имеет цвета, запаха или вкуса. Он также является неметаллом и не проводит электричество в жидком или газообразном состоянии.
Водород может существовать в трех изотопических формах — протий, дейтерий и тритий. Протий является наиболее распространенной и стабильной формой, состоящей из одного протона и одного электрона.
Интересный факт: Водород используется во многих отраслях промышленности, включая производство аммиака, нефтехимической продукции и водородных топливных элементов. Также водород используется в ракетостроении в качестве ракетного топлива.
Молекулярная формула аммиака
Молекулярная формула аммиака представляет собой NH3. Это означает, что одна молекула аммиака состоит из одного атома азота (N) и трёх атомов водорода (H). Азотный атом образует центральный атом, к которому ковалентно связаны водородные атомы.
Молекула аммиака обладает пирамидальной формой из-за наличия несвободной валентной пары электронов на азотном атоме. Это делает аммиак полюсным соединением, в котором азотный атом носит отрицательный заряд, а водородные атомы — положительный заряд.
Молекулярная формула аммиака позволяет определить его структуру и свойства. Например, водородные связи между аммиачными молекулами делают аммиак летучим веществом с высокой температурой кипения (-33,34 °C) и относительно высокой теплотой испарения.
Видео:Аммиак: как образуется и с чем реагирует? #аммиак #химия #видеоурок #егэхимияСкачать

Физические свойства аммиака
Аммиак обладает низкой плотностью и малой вязкостью. Его плотность при нормальных условиях составляет около 0,77 г/см³, что делает его легче воздуха (плотность воздуха – около 1,22 г/см³). Аммиак отличается высокой теплоемкостью и термической проводимостью.
Также стоит отметить, что аммиак хорошо растворяется в воде. При растворении он образует аммиачную воду, которая обладает щелочными свойствами. Аммиакная вода широко применяется в промышленности и быту как удобное щелочное средство.
| Свойство | Значение |
|---|---|
| Температура кипения | -33,35 °C |
| Температура плавления | -77,7 °C |
| Плотность | 0,77 г/см³ |
| Вязкость | 0,295 cP |
Температура кипения
Одним из важных факторов, влияющих на температуру кипения, является растворимость других веществ в аммиаке. Растворение солей или кислот в аммиаке приводит к повышению его температуры кипения. Например, добавление аммиака в раствор серной кислоты приводит к образованию суммарной газовой среды, которую называют кислотным аэрозолем. При этом температура кипения такой среды повышается по сравнению с чистым аммиаком.
Температура кипения аммиака имеет важное значение для промышленности. На основе этого вещества производят аммиачную селитру, удобрения, а также используют в сельском хозяйстве для обработки почвы.
Температура замерзания
В условиях комнатной температуры и атмосферного давления аммиак существует в виде цветлых аммиачных паров. Однако при понижении температуры до указанного диапазона аммиак превращается в белые кристаллы, которые легко растворяются в воде, образуя аммиакальный раствор.
Температура замерзания аммиака является значимым свойством в ряде прикладных областей, таких как промышленность и лабораторная практика. Знание температуры замерзания позволяет контролировать состояние аммиака при его транспортировке и хранении, а также использовать его в различных процессах и экспериментах.
Плотность
При комнатной температуре и нормальном атмосферном давлении плотность аммиака составляет около 0.73 г/см³. Это значит, что в одном кубическом сантиметре аммиака содержится 0.73 грамма вещества.
Плотность аммиака может изменяться при изменении условий окружающей среды. Например, с увеличением температуры плотность аммиака уменьшается, а с увеличением давления – увеличивается.
Видео:Аммиак. 9 класс.Скачать

Химические свойства аммиака
- Аммиак является щелочью: он образует гидроксид аммония (NH4OH), который может реагировать с кислотами и образовывать соли аммоний. Это делает аммиак важной средой для нейтрализации кислотного раствора или отщелачивания.
- Аммиак растворяется в воде: этот процесс называется гидратацией. При растворении образуется аммиаковый гидрат (NH3•H2O). Раствор аммиака широко используется в лабораторной и промышленной химии.
- Аммиак обладает амфотерными свойствами: это значит, что он может проявлять и кислотные, и щелочные свойства в зависимости от материалов, с которыми реагирует. Например, аммиак реагирует с кислотами (образуя аммонийные соли), а также с основаниями (образуя амиды).
- Аммиак горюч: в присутствии оксидантов аммиак может гореть с ярким пламенем. Это свойство делает его полезным в промышленных процессах, таких как производство удобрений и сжигание отходов.
- Аммиак является растворителем: он может растворять различные вещества, такие как кислоты, соли, металлы и некоторые газы. Растворы аммиака часто используются в аналитической химии для выделения и определения различных химических соединений.
Химические свойства аммиака делают его важным и неотъемлемым компонентом в различных процессах и промышленных секторах. Его способность взаимодействовать с другими веществами делает его ценным инструментом для химической индустрии и науки.
Щелочность
- Растворение аммиака в воде приводит к образованию аммонийной соли и гидроксида аммония. Гидроксид аммония — слабое основание, которое может реагировать с кислотами и образовывать аммонийные соли.
- Аммиак растворяется в воде с образованием аммиачной соли, которая образует гидроксид аммония и отрицательные ионы. Это приводит к повышению уровня щелочности раствора.
- В реакциях с кислотами аммиак выступает в качестве основания и образует соль и воду. Такие реакции могут происходить без вмешательства и довольно интенсивно.
Эти свойства делают аммиак щелочью и придают ему различные применения в промышленности и научных исследованиях.
🔥 Видео
Аммиак и соли аммония. 11 класс.Скачать

Аммиак и соли аммония. Видеоурок 29-30. Химия 9 классСкачать

Строение, получение, основные свойства аммиака | ХимияСкачать

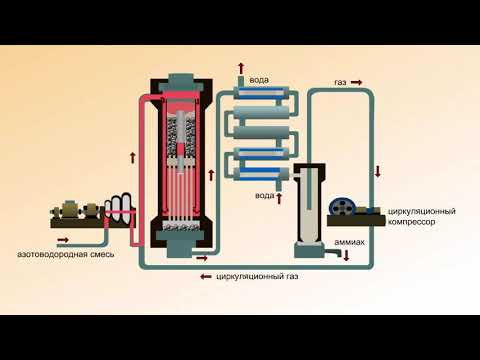
Схема установки для производства аммиакаСкачать
Особенности строения и свойства молекулы азота. 11 класс.Скачать

Азот: свойства и применение. Аммиак. Физические и химические свойства. Получение и применение.Скачать

Аммиак. Химические свойства. Соли аммония | ХимияСкачать

9 класс § 30 "Аммиак. Соли аммония".Скачать

Производство аммиака учебный фильм Союза химиковСкачать

Производство аммиака, 1987Скачать

Элементы 15 (VA) группы. Азот. 9 класс.Скачать

Аммиак за 13 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Промышленное получение аммиака. 11 класс.Скачать

ВСЯ ТЕОРИЯ ПО АМИНАМ ДЛЯ ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать

Как строить структурные формулы быстро, как ФЛЭШ — Мое полное РуководствоСкачать

Взаимодействие растворов аммиака с кислотамиСкачать
