Галогенирование – это реакция, при которой атомы галогенов (фтора, хлора, брома или йода) вступают в химическую связь с другими веществами. Она является одной из основных методов для получения органических и неорганических галогенированных соединений. Принцип галогенирования заключается в замещении одного или нескольких атомов водорода в органическом соединении на атомы галогенов.
Галогенирование может происходить при нормальных условиях (как, например, в случае с хлорированием воды) или при повышенных температурах и давлениях. В зависимости от условий и характера реагентов, галогенирование может протекать по разным механизмам. Однако, наиболее распространенными являются механизмы радикальной и электрофильной замены, а также аддиция.
Процесс галогенирования имеет большое промышленное значение и широко используется во многих отраслях. Одним из примеров галогенирования является получение хлорида винила – основы для производства полимерных материалов, таких как поливинилхлорид (ПВХ). Другим примером является получение галогенированных углеводородов, которые используются в производстве пластиков, лекарств и веществ для фармацевтической промышленности. Галогенирование также применяется в органическом синтезе для создания новых соединений и промежуточных продуктов.
Видео:Видеоурок по химии "Типы химических реакций в органической химии"Скачать

Принципы реакции галогенирования
Реакция галогенирования представляет собой процесс, в ходе которого атомы галогенов (хлора, брома или йода) добавляются к органическим соединениям. Принципы реакции галогенирования определяются характером взаимодействия галогенов с органическими веществами.
Главным принципом реакции галогенирования является электрофильность галогенов. Галогены обладают большой электроотрицательностью, что делает их электрофильными реагентами. Электрофильное галогенирование осуществляется при взаимодействии галогенов с ненасыщенными соединениями, такими как алкены или ароматические соединения. В ходе реакции образуется аддукт, состоящий из галогенной кислоты и органического соединения.
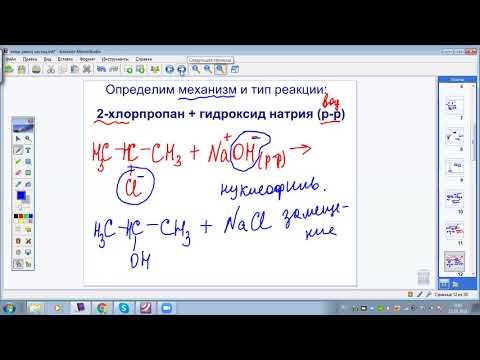
Другим принципом реакции галогенирования является нуклеофильность галогенов. Нуклеофильное галогенирование происходит при взаимодействии галогенов с алкилами или ароматическими аминами. В результате реакции образуется соль галогенида аммония или галогенида аренового катиона.
Механизмы реакции галогенирования различаются в зависимости от типа реагента и реагирующего органического соединения. Радикальный механизм реакции галогенирования основан на образовании радикалов галогенов и органического соединения. Электрофильный механизм атакующий происходит при образовании электрофильных агентов, которые атакуют ненасыщенные связи органического соединения. Механизм замещения заключается в замещении одной функциональной группы другой.
Примеры реакции галогенирования включают галогенирование алканов. В ходе данной реакции атомы галогенов добавляются к молекуле алкана, образуя халогеналканы. Эта реакция широко применяется в химической промышленности для получения различных органических соединений и продуктов.
Электрофильное галогенирование
Данная реакция является одной из наиболее распространенных методов введения галогенов в органические соединения. Как правило, электрофильное галогенирование протекает по следующему механизму:
| Шаг | Описание |
|---|---|
| 1 | Электрофильный реагент-галоген формирует электрофильный центр путем протонирования или другой химической модификации. |
| 2 | Нуклеофильный агент атакует электрофильный центр, образуя промежуточный комплекс. |
| 3 | Промежуточный комплекс распадается, образуя новое соединение с внесенным галогеном и свободный нуклеофильный агент. |
Электрофильное галогенирование может происходить с различными органическими соединениями, например, с алкенами, ароматическими соединениями и другими. Реакция протекает под действием различных электрофильных реагентов-галогенов, таких как хлор, бром и йод.
Примером электрофильного галогенирования может служить реакция добавления хлора к двойной связи этилена:
C2H4 + Cl2 → C2H4Cl2
В данном случае хлор является электрофильным реагентом, который атакует двойную связь этилена, образуя соединение этилендихлорид.
Электрофильное галогенирование широко используется в органическом синтезе для введения галогенных атомов в молекулы. Это позволяет получать соединения со специфическими химическими и физическими свойствами для различных применений.
Нуклеофильное галогенирование
Процесс нуклеофильного галогенирования обычно проявляется в тех случаях, когда атомы водорода в молекуле органического соединения являются относительно неактивными и легко подвергаются замещению. Нуклеофилическая замена атомов водорода позволяет получить галогенированные органические соединения, которые могут использоваться в различных областях, включая фармацевтику и по материаловедению.
При реакции нуклеофильного галогенирования нуклеофиль нападает на электрофильный участок молекулы органического соединения, образуя временную химическую связь с ним. Затем происходит замещение атома водорода атомом галогена, после чего образуется галогенированное соединение.
Наиболее распространенным нуклеофильным галогенированием является замещение атома водорода в алкоголе атомом галогена. Например, этиловый спирт (C2H5OH) может быть галогенирован с помощью хлора, брома или йода, образуя соответственно хлорэтан (C2H5Cl), бромэтан (C2H5Br) или иодэтан (C2H5I).
Однако нуклеофильное галогенирование может происходить не только с алкоголями, но и с другими классами органических соединений, такими как карбоновые кислоты, эфиры, амиды и т. д. В каждом случае нуклеофилом может выступать различный химический соединение, например анионы, аминные группы и другие.
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Механизмы реакции галогенирования
1. Механизм радикалов
Одним из основных механизмов реакции галогенирования является механизм радикалов. В этом механизме, галоген (например, бром) образует радикалы, которые атакуют органическое соединение и замещают атом водорода. Реакция происходит в присутствии света или при высокой температуре.
Пример:
CH4 + Br2 -> CH3Br + HBr
2. Механизм электрофильного атакующего
Другим механизмом реакции галогенирования является электрофильное галогенирование. В этом механизме, галоген образует электрофильный специес, который атакует π-связь в органической молекуле. Реакция происходит в присутствии электрофильного катализатора.
Пример:
C6H6 + Br2 -> C6H5Br + HBr
3. Механизм замещения
Механизм замещения также может играть роль в реакции галогенирования. В этом механизме, галоген атакует органическое соединение, сначала замещая одну из функциональных групп, а затем замещая атомы водорода.
Пример:
CH3CH2OH + Br2 -> CH3CH2Br + HBr
Механизмы реакции галогенирования имеют большое практическое применение и широко используются в синтезе органических соединений. Знание этих механизмов позволяет предсказывать результаты реакций и оптимизировать синтезные процессы.
Механизм радикалов
В процессе радикального галогенирования молекула галогена образует радикал, освобождая один электрон. Этот радикал становится электрофильным и атакует другую молекулу, например, органическую молекулу, образуя промежуточный радикал. В результате реакции образуется новая молекула, содержащая галоген.
Механизм радикалов широко используется в галогенировании алканов. Например, при галогенировании метана молекула хлора образует радикал хлора, который атакует метан, образуя промежуточный радикал метилхлорида. Далее, этот промежуточный радикал может атаковать другую молекулу галогена, образуя конечный продукт — дихлорметан.
Механизм радикалов является важным подходом в органической химии, так как он позволяет контролировать реакцию и выбирать путь образования новых соединений. Кроме того, этот механизм широко используется в различных синтетических процессах и может быть варьирован для получения различных продуктов.
Механизм электрофильного атакующего
Процесс начинается с формирования электрофильного центра на атоме галогена. Этот центр привлекает электрофиль и образует комплекс, затем происходит перенос электрона от электрофильного центра на другую молекулу, что приводит к образованию новой химической связи между галогеном и молекулой.
Механизм электрофильного атакующего широко применяется в органической химии, особенно при галогенировании алкенов, алкинов и ароматических соединений. Этот метод позволяет внедрять галоген в молекулу в нужной позиции, что может быть важно для получения определенных продуктов реакции и регулирования их свойств.
Примером реакции галогенирования по механизму электрофильного атакующего может служить бромирование алкенов. При этой реакции электрофильный бром образует комплекс с двойной связью алкена, а затем происходит образование новой связи между бромом и атомом углерода, что приводит к образованию бромалкана. Этот процесс часто сопровождается сменой цвета реакционной смеси, так как бром имеет ярко-красный цвет, а бромалканы — бесцветные соединения.
Механизм замещения
Механизм замещения может происходить по разным механизмам, в зависимости от конкретных условий реакции. Одним из наиболее распространенных механизмов замещения является механизм замещения через образование промежуточного комплекса, в котором галоген образует связь с атомом углерода.
Примером реакции замещения является реакция галогенирования алканов. В этой реакции атомы галогена замещают атомы водорода в молекуле алкана. Например, при реакции бромирования метана, один атом водорода замещается атомом брома, образуя молекулу бромометана.
Механизм замещения является важным для понимания и изучения реакции галогенирования. Он позволяет объяснить множество химических превращений, происходящих в органических соединениях под действием галогенов.
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Примеры реакции галогенирования
Галогенирование алканов:
Одним из примеров реакции галогенирования является реакция хлорирования метана. При данной реакции метан (CH4) взаимодействует с хлором (Cl2) в присутствии обычно ультрафиолетового излучения. В результате образуется хлорметан (CH3Cl), фреон-40 (t—CH3Cl) и другие хлорированные производные. Процесс галогенирования алканов широко применяется в промышленности для получения хлорсодержащих органических соединений, используемых, например, в производстве пластиков и реагентов.
Галогенирование алканов также может быть применено для получения полубриллиантового газа. Например, реакция хлорирования этилена (C2H4) приводит к образованию 1,2-дихлорэтана (C2H4Cl2), который используется в производстве полиэтилена и других полимеров.
Примечание: при использовании данной статьи в академических целях, обязательно укажите источник.
Галогенирование алканов
Галогенирование алканов может происходить с помощью различных механизмов, таких как радикальный механизм и электрофильный механизм атакующего. В радикальном механизме галогенирования алканов, галоген проявляет свои радикальные свойства и реагирует с алканом, образуя алкиловый радикал. Алкиловый радикал может затем реагировать с галогеном, образуя галогенированный алкан и галогенильный радикал. В электрофильном механизме галогенирования алканов электрофильный галоген атакует алкан, образуя промежуточный комплекс, который затем диссоциирует, образуя галогенированный алкан.
Галогенирование алканов применяется в различных областях, включая органическую химию и синтез органических соединений. Этот процесс позволяет получить галогенированные алканы, которые могут использоваться в качестве промежуточных продуктов в синтезе других органических соединений. Кроме того, галогенированные алканы можно использовать в качестве реагентов и катализаторов в различных химических реакциях.
📽️ Видео
Антипин Р.Л. Механизмы реакций - основные трудности при изучении курса органической химииСкачать

Типы реакций в органической химии. [7] Органика С НУЛЯ | Химия для 10 класса и ЕГЭ-2024Скачать
![Типы реакций в органической химии. [7] Органика С НУЛЯ | Химия для 10 класса и ЕГЭ-2024](https://i.ytimg.com/vi/QTeVsPkJiOE/0.jpg)
механизмы реакций в органической химииСкачать
Механизмы органических реакцийСкачать

Реакции с участием органических веществСкачать

Механизм реакций замещения | Химия ЕГЭ 10 класс | УмскулСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Все качественные реакции в органике | Химия ЕГЭ 2022 | УмскулСкачать

Именные реакции в органической химии | Химия ЕГЭСкачать

Реакции присоединения и полимеризации в органике | Химия ЕГЭ | УмскулСкачать

Типы химических реакций в органической химии (электрофильный механизм).Скачать

Как БЫСТРО понять Химию? Органическая Химия с нуляСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Химические свойства алканов. 1 часть. 10 класс.Скачать

Механизмы органических реакций: основные трудности изучения школьного курса органической химииСкачать

Типы химических реакций в органической химии (радикальный механизм).Скачать

Механизмы органических реакцийСкачать
