Органические соединения — это химические соединения, основанные на углероде, который способен образовывать связи с другими атомами углерода и другими элементами. За счет такого многообразия связей и структур, органические соединения являются основой жизни на Земле: все органические вещества, содержащиеся в живых организмах, состоят из углерода.
Классификация органических соединений базируется на различии в атомном составе и структуре молекулы. Существует несколько основных типов органических соединений, включая алканы, алкены, алкины, арены, спирты, альдегиды, кетоны, карбоновые кислоты, эфиры, эстеры, амины и нитро соединения.
Алканы — это насыщенные углеводороды, каждый из которых содержит только одинарные связи между атомами углерода. Примерами алканов являются метан (CH4), этан (C2H6), пропан (C3H8) и бутан (C4H10).
Алкены и алкины — это несвязанные углеродные соединения, которые содержат двойную и тройную связи соответственно. Примеры алкенов включают этилен (C2H4) и пропилен (C3H6), а примеры алкинов — ацетилен (C2H2) и пропин (C3H4).
Арены представляют собой циклические соединения, содержащие ароматические ядра, такие как бензол. Арены часто используются в производстве пластиков, лекарств и других продуктов.
Спирты — это соединения, в которых атом водорода замещен гидроксильной группой (ОН). Примерами спиртов являются метанол (СН3OH) и этиловый спирт (С2Н5ОН).
Карбоновые кислоты — это органические соединения, в которых группа -СООН присоединена к углеродной цепи. Примерами карбоновых кислот являются уксусная кислота (С2Н4О2) и стеариновая кислота (С18Н36О2).
Это только небольшой обзор разнообразия органических соединений. Каждый тип соединения обладает своими уникальными свойствами и может быть использован для различных целей, начиная от пищевой промышленности до медицины и электроники.
- Органические соединения: определение и значения
- Типы органических соединений
- Алканы: свойства и примеры
- Систематическое название алкана
- Физические свойства алкана
- Примеры алканов
- Алкены: свойства и примеры
- Систематическое название алкена
- Физические свойства алкена
- Примеры алкенов
- Алкины: свойства и примеры
- Систематическое название алкина
- Физические свойства алкина
- Примеры алкинов
- Ароматические соединения: свойства и примеры
- Систематическое название ароматического соединения
- Физические свойства ароматического соединения
- Примеры ароматических соединений
- Свойства органических соединений
- Электрофильность и нуклеофильность
- Химическая стабильность
- Растворимость в различных средах
- 🎥 Видео
Видео:Классификация органических соединений. 9 класс.Скачать
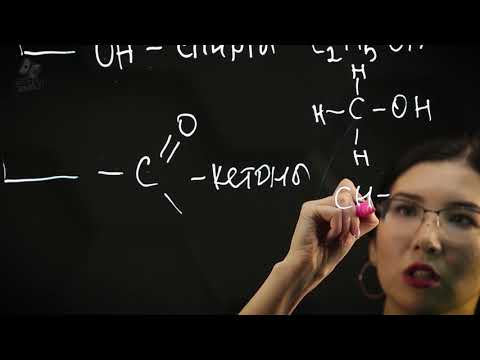
Органические соединения: определение и значения
Органические соединения имеют широкий спектр значений в различных областях науки и технологии. Они играют важную роль в органической химии, биологии, фармацевтике, пищевой промышленности, полимерной промышленности и других областях.
Органические соединения имеют разнообразные свойства и значения, которые определяют их использование. Молекулы органических соединений могут обладать свойствами, такими как реакционная активность, кислотно-основные свойства, ароматичность, оптическая активность и многие другие.
Примеры органических соединений включают углеводы, жиры, белки, нуклеиновые кислоты, алканы, алкены, алкоголи, амины, эфиры и многие другие. Каждый из этих классов органических соединений имеет свои уникальные свойства и значения, что делает их полезными в различных областях.
Видео:Классификация органических веществ. 1 часть. 10 класс.Скачать

Типы органических соединений
Органические соединения классифицируются в зависимости от свойств и структуры их молекул. Ниже приведены основные типы органических соединений:
| Тип соединений | Описание | Примеры |
|---|---|---|
| Углеводороды | Молекулы, состоящие только из атомов углерода и водорода | Метан, этан, пропан, бензол |
| Алкоголи | Органические соединения, содержащие гидроксильную группу | Метанол, этанол, глицерин |
| Кетоны | Органические соединения, содержащие карбонильную группу с кетоновым кислородом | Ацетон, пропанон, ацетофенон |
| Амины | Органические соединения, содержащие одну или несколько аминогрупп | Этиламин, анилин, морфин |
| Карбоновые кислоты | Органические соединения, содержащие карбоксильную группу | Уксусная кислота, масляная кислота, бензойная кислота |
| Эфиры | Органические соединения, образованные соединением карбонильной группы с алкоксильной группой | Этиловый эфир, метиловый эфир, эфир салициловой кислоты |
Классификация органических соединений помогает упорядочить и изучить их свойства, а также понять взаимосвязь между различными типами соединений.
Видео:Классификация органических соединений | Химия ЕГЭ 10 класс | УмскулСкачать

Алканы: свойства и примеры
Основные свойства алканов:
- Низкая химическая активность. Алканы являются стабильными и мало реакционоспособными соединениями.
- Низкая теплота сгорания. Алканы обладают высокой теплотой сгорания, что делает их отличным источником энергии.
- Не растворимость в воде. Алканы плохо растворяются в воде, но хорошо растворяются в неорганических растворителях и органических растворителях.
- Плавучесть. Алканы имеют меньшую плотность, чем вода, поэтому они плавают на ее поверхности.
Примеры алканов:
- Метан (CH4)
- Этан (C2H6)
- Пропан (C3H8)
- Бутан (C4H10)
- Пентан (C5H12)
Систематическое название алкана
Для систематического названия алкана используется префикс, который отражает количество углеродных атомов. Например, алкан с одним углеродным атомом называется метан, алкан с двумя углеродными атомами — этан, с тремя — пропан, и так далее.
Кроме префикса, в систематическом названии алкана может быть указано и суффиксное окончание, которое указывает на тип химической связи. Суффикс «-ан» обозначает, что все связи в молекуле алкана являются одинарными.
Например, систематическое название алкана с пятью углеродными атомами будет пентан.
Систематическое название алкана позволяет однозначно идентифицировать соединение и его структуру. Оно играет важную роль в органической химии, чтобы ученые могли точно определить состав и свойства вещества.
Физические свойства алкана
Алканы, как простейшие представители органических соединений, обладают рядом характерных физических свойств, которые определяются их структурой и межмолекулярными взаимодействиями. Вот некоторые из них:
- Точка кипения: Алканы имеют низкую температуру кипения, поскольку межмолекулярные силы взаимодействия слабы. Температура кипения алканов возрастает с увеличением числа углеродных атомов в молекуле.
- Точка плавления: Алканы являются нежирными веществами с низкой температурой плавления. Температура плавления алканов увеличивается с увеличением числа углеродных атомов в молекуле.
- Плотность: Плотность алканов увеличивается с увеличением числа углеродных атомов в молекуле.
- Топливные свойства: Алканы служат важным источником энергии, поскольку горят при сжигании, образуя углекислый газ и воду. Они обладают высокими теплотворными свойствами и используются в качестве топлива.
- Растворимость: Алканы плохо растворяются в воде, поскольку они являются неполярными веществами. Однако, они хорошо растворяются в органических растворителях, таких как бензол и эфир.
Эти физические свойства алканов играют важную роль в их применении в различных областях, таких как нефтепереработка, производство пластмасс, фармацевтическая промышленность и многое другое.
Примеры алканов
Примеры алканов включают:
- Метан (CH4) — самый простой алкан, который является основным компонентом природного газа;
- Этан (C2H6) — используется в качестве горючего в бытовых условиях;
- Пропан (C3H8) — используется в качестве горючего газа и пропановых баллонов;
- Бутан (C4H10) — также используется в качестве горючего газа и баллонов, а также в портативных плитах и горелках;
- Пентан (C5H12) — используется в лабораториях и в качестве растворителя;
- Гексан (C6H14) — используется в промышленности в качестве растворителя;
- Гептан (C7H16) — используется в процессе дистилляции и в качестве растворителя;
- Октан (C8H18) — составляет основу восьмиуглеродного бензина, который используется в автомобильных двигателях;
- Нонан (C9H20) — широко используется в производстве пластиков, резин и пестицидов;
- Декан (C10H22) — используется в производстве восков и масла, а также в составе топлива.
Это лишь некоторые из множества алканов, которые встречаются в природе или производятся искусственно. Каждый алкан имеет свои уникальные свойства и области применения.
Видео:Названия в ОРГАНИКЕ | КАК ПРАВИЛЬНО называть химические вещества и элементы?Скачать

Алкены: свойства и примеры
Основные свойства алкенов:
1. Двойная связь — главная структурная особенность алкенов. Она является понижающим фактором и делает их более активными по сравнению с алканами, которые содержат только одинарные связи.
2. Однонаправленность двойной связи — алкены имеют две атомные группы, прикрепленных к двойной связи. Одна из групп может быть замещена, а другая — нет. Это свойство дает возможность синтезировать широкий спектр органических веществ.
3. Способность к полимеризации — алкены могут проходить химическую реакцию, называемую полимеризацией, в которой мономеры объединяются, образуя полимер. Это делает алкены полезными в производстве пластиков, волокон и других материалов.
Примеры алкенов:
Этилен — самый простой алкен, он используется в промышленности для производства пластиков, синтетических волокон и резиновых изделий.
Пропен — алкен соединение с тремя атомами углерода. Он широко используется в производстве полимеров и веществ, таких как пропилен.
Бутен — алкен с четырьмя атомами углерода. Он используется в производстве резиновых изделий и при изготовлении синтетических волокон.
Алкены — это важный класс органических соединений с уникальными свойствами и широким спектром применений в различных областях промышленности и химии.
Систематическое название алкена
1. Определите, сколько атомов углерода содержится в молекуле алкена.
2. Подсчитайте количество атомов водорода. Помните, что для алкенов общая формула CnH2n.
3. Определите, на каком атоме углерода начинается двойная связь.
4. Назовите основную цепь как название соответствующего алкана, и укажите номер атома, на котором начинается двойная связь.
5. Добавьте суффикс «-ен» к названию алкана, чтобы указать на присутствие двойной связи.
6. Если молекула содержит какую-либо функциональную группу, добавьте ее название перед названием алкена.
Например:
Этен — алкен, состоящий из двух атомов углерода и четырех атомов водорода. У двойной связи начальный атом углерода имеет номер 1. Основная цепь — этилен. Соответственно, систематическое название этого алкена — этилен.
Пропен — алкен, состоящий из трех атомов углерода и шести атомов водорода. У двойной связи начальный атом углерода имеет номер 1. Основная цепь — пропан. Поэтому, систематическое название этого алкена — пропен.
Таким образом, систематическое название алкена зависит от его структуры и может быть определено с помощью простых правил.
Физические свойства алкена
Алкены представляют собой класс органических соединений, у которых между углеродными атомами имеется двойная связь. Физические свойства алкенов определяются их молекулярной структурой и свойствами межмолекулярного взаимодействия веществ.
Одним из главных физических свойств алкенов является их плавучесть. Большинство алкенов являются легкими нефтяными фракциями и обладают низкой плотностью. Это позволяет им скапливаться вверху нефтяной смеси и легко разделяться от более тяжелых компонентов.
Алкены также обладают небольшой вязкостью. Это связано с наличием двойной связи, которая создает препятствие для свободного скольжения молекул друг относительно друга. Вязкость алкенов может изменяться в зависимости от длины углеродной цепи и наличия боковых групп в молекуле.
Большинство алкенов имеют низкую температуру плавления и кипения. Это связано с наличием двойной связи, которая создает дополнительные силы притяжения между молекулами. Более длинные алкены имеют более высокие температуры плавления и кипения, так как у них больше межмолекулярных взаимодействий.
Алкены обладают некоторой растворимостью в воде. Небольшие алкены, такие как этилен и пропен, имеют возможность образования водородных связей с водой, что делает их незначительно растворимыми. Однако более длинные алкены обычно не растворяются в воде из-за большей гидрофобности углеродной цепи.
Физические свойства алкенов могут быть также модифицированы введением различных функциональных групп, которые могут влиять на их молекулярную структуру и межмолекулярные взаимодействия.
Примеры алкенов
Примеры алкенов:
- Этен (этилен) — CH2=CH2
- Пропен (пропилен) — CH2=CH-CH3
- Бутилен — CH2=CH-CH2-CH3
- Изобутилен — CH2=C(CH3)2
- Гексен — CH2=CH-CH2-CH2-CH2-CH3
Алкены находят широкое применение в органической химии и промышленности. Они являются важными промежуточными продуктами в процессах производства пластиков, эластомеров и других полимеров. Алкены также являются сырьем для получения различных органических соединений, таких как спирты, альдегиды и кислоты.
Видео:Как БЫСТРО понять Химию? Органическая Химия с нуляСкачать

Алкины: свойства и примеры
Основные свойства алкинов:
| Свойство | Описание |
|---|---|
| Тройная связь | Присутствие тройной связи делает алкины более реакционноспособными. |
| Кратные связи | Алкины могут содержать несколько тройных связей. |
| Кислородные связи | Алкины могут образовывать соединения с кислородом, образуя альдегиды и кетоны. |
| Горючесть | Алкины являются очень горючими веществами. |
Примеры алкинов:
1. Этилен (С2H4) — наиболее простой алифатический алкин.
2. Ацетилен (C2H2) — алкин, который используется в промышленности для получения органических соединений и в сварке.
3. Пропин (C3H4) — алкин, применяемый в химическом синтезе.
4. Бутини (C4H6) — группа алифатических алкинов с различными атомами водорода и группами.
Алкины являются важным классом органических соединений, которые имеют широкое применение в химической промышленности и синтезе органических соединений.
Систематическое название алкина
Систематическое название алкина представляет собой название органического соединения, содержащего тройную связь между углеродными атомами. Для того, чтобы правильно назвать алкин, необходимо выполнить следующие правила:
- Определить число углеродных атомов в молекуле алкина.
- Присвоить каждому углеродному атому порядковый номер.
- Определить, какие из углеродных атомов являются частью тройной связи.
- Начать нумерацию атомов, так чтобы номера углеродных атомов, содержащих тройную связь, были минимальными.
- Поставить перед названием алкина (производного алкана) приставку, указывающую на наличие тройной связи.
Например, для алкина с формулой C₃H₄ есть два возможных систематических названия:
метилакетин;
пропин.
Физические свойства алкина
Одним из основных физических свойств алкинов является высокая температура кипения и плавления. Например, этилен (C2H4), который является простейшим алкином, имеет температуру кипения -104 градуса Цельсия. Более сложные алкины могут иметь еще более высокую температуру кипения.
Другим важным физическим свойством алкинов является низкая плотность. Это связано с их молекулярной структурой, так как атомы углерода и водорода имеют малую атомную массу. Благодаря низкой плотности алкины могут быть легкими и хорошо разделиться от других компонентов в реакционной смеси.
Кроме того, алкины обладают низкой полярностью. Это означает, что они плохо растворяются в полярных растворителях, таких как вода. Однако, алкины могут хорошо растворяться в неполярных растворителях, таких как бензол или этер.
Также алкины могут быть легкими для горения. Они обладают высокой температурой горения и часто используются в качестве горючего материала. Кроме того, алкины обладают высокой степенью реакционной активности и могут участвовать во многих органических реакциях, таких как аддиционные и окислительные реакции.
Все эти физические свойства алкинов делают их интересными для различных промышленных и научных приложений. Изучение этих свойств позволяет лучше понимать структуру и свойства алкинов, а также их роль в органической химии и в промышленности.
Примеры алкинов
| Название | Структурная формула | Молекулярная формула |
|---|---|---|
| Этен | C2H4 | |
| Пропен | C3H6 | |
| Бутин | C4H6 |
Это лишь несколько примеров алкинов, существует множество других соединений, в которых присутствуют двойные связи между углеродными атомами. Алкены имеют широкое применение в промышленности и бытовой химии.
Видео:КАЖДЫЙ ШКОЛЬНИК поймет химию — Типы ИзомерииСкачать

Ароматические соединения: свойства и примеры
Свойства ароматических соединений:
- Ароматичность: обладают приятным запахом.
- Стабильность: образуют устойчивые соединения, не подверженные легкому разрушению или окислению.
- Сопротивляемость химическим реакциям: обычно ароматические соединения реактивны, но они могут проявлять сопротивляемость к некоторым химическим изменениям.
Примеры ароматических соединений:
- Бензол (C6H6): самый простой ароматический углеводород, имеющий характерный сладкий запах. Применяется в производстве пластмасс, лаков и резиновых изделий.
- Толуол (C7H8): обладает фруктовым запахом и широко используется в производстве красок, растворителей и промышленных реагентов.
- Фенол (C6H5OH): имеет специфический сладковатый запах и широко применяется в производстве смол, лекарственных препаратов и антисептиков.
- Нафталин (C10H8): обладает характерным запахом и применяется в производстве красителей, моющих средств и антимолевых средств.
Систематическое название ароматического соединения
Систематическое название ароматического соединения образуется по правилам систематической номенклатуры органических соединений. Оно включает указание наличия ароматического кольца и числа заместителей, а также их положение относительно кольца.
Например, бензол, самое простое ароматическое соединение, имеет систематическое название циклогекса-1,3,5-триен.
Другим примером ароматического соединения является толуол, систематическое название которого метилбензен.
Таким образом, систематическое название ароматического соединения является важным инструментом для идентификации и классификации этих соединений среди разнообразных органических соединений.
Физические свойства ароматического соединения
Ароматические соединения, также известные как арены, обладают рядом характерных физических свойств, которые делают их уникальными среди органических соединений.
1. Ароматический запах: Одной из ключевых особенностей ароматических соединений является их запах, который часто приятный и характерный для каждого конкретного соединения.
2. Растворимость: Многие ароматические соединения обладают значительной растворимостью в органических растворителях, таких как этер, ацетон и бензол. Однако, их растворимость в воде обычно невысокая, так как ароматические соединения обладают гидрофобными свойствами.
3. Точка плавления и кипения: Ароматические соединения обычно имеют высокую точку плавления и кипения. Это связано с присутствием межмолекулярных взаимодействий, таких как ароматические взаимодействия и водородные связи.
4. Плотность: Плотность ароматических соединений обычно выше, чем у воды, из-за их молекулярной структуры и массы.
5. Цвет: Многие ароматические соединения обладают интенсивным цветом, который может варьироваться от безцветного до насыщенных оттенков.
Эти физические свойства делают ароматические соединения ценными в различных областях, таких как парфюмерия, фармацевтика, пищевая промышленность и другие.
Примеры ароматических соединений
| Название | Пример |
|---|---|
| Бензол | C6H6 |
| Толуол | C7H8 |
| Нафталин | C10H8 |
| Антрацен | C14H10 |
| Фенол | C6H6O |
| Ванилин | C8H8O3 |
Это лишь некоторые примеры ароматических соединений, которые широко используются в различных отраслях промышленности.
Видео:Состав и структура органических веществ. Изомерия. 1 часть. 10 класс.Скачать

Свойства органических соединений
Органические соединения обладают разнообразными свойствами, которые определяют их химическую и физическую природу.
Один из основных типов свойств органических соединений — пластичность. Они могут быть мягкими и деформируемыми под давлением или теплом. Это позволяет создавать различные формы и структуры органических соединений.
Другим важным свойством органических соединений является реактивность. Они способны образовывать химические связи и участвовать в реакциях с другими веществами. Реактивность органических соединений зависит от их структуры и функциональных групп.
Также, органические соединения обладают различными физическими свойствами, такими как температура плавления и кипения, плотность, растворимость в различных растворителях.
Кроме того, органические соединения могут обладать определенными биологическими свойствами, такими как токсичность, антибактериальная или антивирусная активность, способность взаимодействовать с биологическими молекулами.
Примерами органических соединений с различными свойствами могут служить углеводы, жиры, белки, алкоголи, алдегиды, кетоны, эфиры и др.
Видео:Классификация органических соединений. Химия 10 классСкачать

Электрофильность и нуклеофильность
Электрофильность — это способность атома или группы атомов в молекуле привлекать электроны. Электрофильное вещество ищет электроны, чтобы сформировать новые химические связи с другим веществом. Электрофильное центральное атомное ядро имеет недостаток электронов, что делает его электрондефицитным. Хорошими примерами электрофильных групп могут служить электрондефицитные атомы, такие как атомы кислорода или азота с положительным зарядом, а также группы, содержащие двойные или тройные связи.
Нуклеофильность — это способность атома или группы атомов в молекуле предоставить электроны. Нуклеофильное вещество ищет электрофиль, чтобы передать ему свои электроны и образовать новые химические связи. Нуклеофильное центральное атомное ядро обладает избытком электронов, что делает его электронобогатым. Хорошими примерами нуклеофильных групп являются атомы кислорода или азота с отрицательным зарядом, а также атомы, обладающие свободными парами электронов.
Реакция электрофильного и нуклеофильного вещества представляет собой взаимодействие электрофильного и нуклеофильного центров, которое приводит к образованию новой химической связи. Эта взаимодействие может протекать по различным механизмам, таким как присоединение электрофильного атома к нуклеофильному атому или образование тетраэдричного промежуточного комплекса.
Важно отметить, что электрофильность и нуклеофильность могут быть изменены с помощью различных факторов, таких как силы и типы взаимодействия, окружающая среда и структурные особенности молекулы. Электрофильность и нуклеофильность играют ключевую роль в понимании реакций органических соединений и выборе оптимальных условий для их проведения.
Видео:Теория химического строения органических соединений А.М. Бутлерова. Органика 1Скачать

Химическая стабильность
Химическая стабильность может зависеть от различных факторов, включая молекулярную структуру соединения, наличие функциональных групп, наличие связей с определенной энергией, а также условия окружающей среды.
Необходимо отметить, что не все органические соединения обладают высокой химической стабильностью. Некоторые соединения могут быть очень реакционноспособными и подвергаться различным превращениям под воздействием тепла, света, кислот или щелочей.
В то же время, существуют органические соединения, которые обладают высокой химической стабильностью и могут сохранять свои химические свойства в течение продолжительного времени. Такие соединения могут быть использованы в различных областях науки и техники, включая фармацевтику, пищевую промышленность, электронику и др.
Примерами органических соединений с высокой химической стабильностью являются инертные газы, алканы, полиэтилен и др.
Однако, стоит отметить, что даже химически стабильные соединения могут быть подвержены деградации или разложению при воздействии определенных условий, например, при повышенных температурах или под воздействием радикалов.
Видео:Номенклатура органических соединений. 1 часть. 10 класс.Скачать

Растворимость в различных средах
Вода является одной из наиболее распространенных сред, в которых органические соединения растворяются. Множество органических соединений обладает высокой растворимостью в воде, особенно те, которые могут образовывать водородные связи или имеют полярные группы. Примерами таких соединений могут быть этиленгликоль, метанол и ацетон.
С другой стороны, некоторые органические соединения слабо растворяются в воде или вообще не растворяются из-за отсутствия полярных групп или наличия гидрофобных характеристик. К ним относятся, например, масла, жиры и бензол.
Органические соединения также могут растворяться в других средах, таких как органические растворители или некоторые жидкие металлы. Растворимость в органических растворителях может быть высокой или низкой в зависимости от соответствующих взаимодействий между молекулами соединений и растворителя. К примеру, этанол, ацетон и хлороформ обладают высокой растворимостью в органических растворителях, таких как эфир, толуол или бензин.
Органические соединения также могут быть растворимыми в некоторых жидких металлах, таких как ртуть или галлий. Растворимость в этих металлах может быть обусловлена их плотностью, вязкостью и другими физическими свойствами.
Растворимость органических соединений в различных средах является важным аспектом в химических процессах, таких как синтезы, экстракции и очистка веществ. Она может быть контролируема с помощью подбора соответствующих растворителей и условий реакции.
🎥 Видео
Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

ВСЕ КЛАССЫ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙСкачать

Составление формул органических соединений по названиюСкачать

Кислотные, основные свойства органических соединений. Часть 1.Скачать

КАК ДАВАТЬ НАЗВАНИЯ органическим соединениям | КАК СОСТАВЛЯТЬ ФОРМУЛЫ в органической химииСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Классификация углеводородовСкачать

Номенклатура органических соединенийСкачать

Химия с нуля — АЛКИНЫ, Тройная связь, Типы Гибридизации // Органическая ХимияСкачать
