Белки являются одними из основных молекул, составляющих живые организмы. Они выполняют множество важных функций, таких как транспорт веществ, катализ химических реакций, передача сигналов и поддержание структурных компонентов клеток и тканей. Изучение белков и их классификация являются важными задачами биохимии и молекулярной биологии.
Белки могут быть классифицированы по различным критериям, одним из которых является их состав аминокислотных остатков. Существуют 20 различных аминокислот, из которых строятся белки. Их порядок в полипептидной цепи определяется генетической информацией, закодированной в ДНК. В результате объединения аминокислотных остатков образуются четыре уровня организации структуры белка: первичная, вторичная, третичная и кватерническая структуры.
Первичная структура представляет собой последовательность аминокислотных остатков в полипептидной цепи. Она определяется генетическим кодом и может быть различной для разных видов организмов и даже внутри одного организма. Первичная структура непосредственно влияет на свойства и функции белка.
Вторичная структура определяется пространственными взаимодействиями между атомами аминокислотных остатков в полипептидной цепи. Основными формами вторичной структуры являются α-спираль и β-листы. Они образуются за счет водородных связей между атомами водорода и кислорода, находящимися в близлежащих остатках. Вторичная структура придает белкам некоторую устойчивость и может участвовать в пространственном складывании белковой цепи.
Третичная структура представляет собой пространственное складывание полипептидной цепи в трехмерную структуру. Она определяет конкретную форму белка и может быть связана с его функцией. Третичная структура обусловлена взаимодействием различных групп атомов (боковых цепей аминокислотных остатков) и может включать в себя образование петель и спиралей.
Кватерническая структура относится к структуре белков, состоящих из нескольких полипептидных цепей. Эти цепи могут быть связаны друг с другом при помощи различных сил, таких как водородные связи, гидрофобные взаимодействия и ионные взаимодействия. Кватерническая структура может быть критической для функции белка, поскольку она может обеспечивать устойчивость и оптимальное взаимодействие с другими молекулами.
- Определение белков
- Структура белков
- Функции белков
- Важность классификации белков
- Почему нужно классифицировать белки?
- Как происходит классификация белков?
- Классификация белков по функции
- Структурные белки
- Ферменты
- Транспортные белки
- Ферменты
- Антитела
- Структура антител
- Классификация антител
- Гормоны
- Белковые гормоны
- Стероидные гормоны
- Классификация белков по составу
- Классификация белков по количеству аминокислот
- Классификация белков по составу аминокислот
- Простые белки
- Сложные белки
- Нуклеопротеиды
- Хроматин
- Нуклеосомы
- Классификация белков по структуре
- Простая структура
- Сложная структура
- Мономерные белки
- Структура мономерных белков
- Примеры мономерных белков
- Олигомерные белки
- Фиброзные белки
- Структура фиброзных белков
- Функции фиброзных белков
- Классификация белков по полуразрушаемости
- Лабильные белки
- Стабильные белки
- Протеиназоустойчивые белки
- Механизмы протеиназоустойчивости
- Применение протеиназоустойчивых белков
- 📹 Видео
Видео:Белки. 10 класс.Скачать

Определение белков
Структура белков
Белки имеют сложную трехмерную структуру, которая обеспечивает их специфичность и функциональность. Они состоят из одного или нескольких полипептидных цепей, связанных друг с другом и синтезируемых в результате трансляции генетической информации.
Основные уровни структуры белка включают:
- Первичную структуру — последовательность аминокислот, составляющих белок;
- Вторичную структуру — пространственное расположение участков цепи белка, таких как спиральная альфа-структура и протяженные бета-складки;
- Третичную структуру — трехмерное свернутое состояние всей цепи белка;
- Кватернарную структуру — взаимное расположение и связи между разными полипептидными цепями, если они присутствуют.
Функции белков
Белки выполняют различные функции в организме, включая:
- Строительную функцию — участие в формировании клеточных структур и тканей;
- Функцию ферментов — участие в регуляции биохимических реакций;
- Транспортную функцию — перенос молекул и ионов через мембраны;
- Регуляторную функцию — контроль генной экспрессии и сигнальные пути;
- Иммунную функцию — защита организма от инфекций и болезней.
Изучение белков и их классификация по составу и структуре позволяют лучше понять их функции и взаимодействие с другими молекулами, что имеет большое значение для развития новых лекарственных препаратов и технологий в медицине и биотехнологии.
Видео:Л.7 | БЕЛКИ | Состав и строение белков | ОБЩАЯ БИОЛОГИЯ ЕГЭСкачать

Важность классификации белков
Классификация белков основывается на их физико-химических свойствах, структуре и функциональных характеристиках. Она позволяет разделить белки на категории и придать им определенное значение и роль. Это помогает ученым систематизировать знания о белках и организовать их в базы данных, доступные для дальнейшего исследования.
Почему нужно классифицировать белки?
Классификация белков позволяет ученым понять, как разные белки функционируют и взаимодействуют друг с другом. Это важно для изучения многих биологических процессов, таких как метаболизм, сигнальные пути и иммунная система. Классификация также помогает определить, какие белки играют ключевую роль в различных болезнях и патологических состояниях.
Белки имеют сложную трехмерную структуру, и классификация позволяет исследователям определить их особенности и функции на уровне атомарных взаимодействий. Это полезная информация при разработке новых лекарств и терапевтических подходов, основанных на целенаправленной модуляции конкретных белков или их взаимодействий.
Как происходит классификация белков?
Существует несколько методов классификации белков, включая классификацию по структуре, функции и по генетическим свойствам. Классификация по структуре основывается на анализе пространственной организации аминокислотных остатков в белке и позволяет выделить различные фолды и домены.
Классификация по функции основывается на понимании биологических ролей белков и их взаимодействия с другими молекулами в клетке. Генетическая классификация основывается на сходстве генетической последовательности белков и позволяет установить эволюционные связи между различными видами.
Классификация белков является динамическим процессом, поскольку непрерывно открываются новые виды и группы белков. Постоянное обновление и улучшение классификации способствуют новым открытиям и расширяют наше понимание мира белковых структур и функций.
Видео:Строение и уровни структурной организации белков. 10 класс.Скачать

Классификация белков по функции
Белки выполняют множество различных функций в организмах живых существ. Их классификация по функции основана на роли, которую они играют в клеточных процессах и биохимических реакциях.
Структурные белки
Структурные белки представляют собой основные компоненты клеток. Они формируют кишечник клеток, обеспечивают прочность и устойчивость различных тканей и органов. Такие белки, как коллаген и кератин, являются примерами структурных белков.
Ферменты
Ферменты являются катализаторами биохимических реакций в организмах. Они участвуют в синтезе и разрушении молекул, обеспечивая правильное функционирование клеток. Ферменты включают такие важные классы белков, как гидролазы, оксидоредуктазы и другие.
Гидролазы: катализируют гидролиз молекул, разбивая их на более простые компоненты.
Оксидоредуктазы: участвуют в окислительно-восстановительных реакциях, передвигая электроны от одной молекулы к другой.
Транспортные белки
Транспортные белки переносят различные вещества через клеточные мембраны или внутри клетки. Они обеспечивают доставку необходимых питательных веществ и метаболических продуктов в клетки, а также удаление отходов из организма. Примерами транспортных белков являются гемоглобин и нейротрансмиттеры.
Таким образом, классификация белков по функции помогает лучше понять их роль в организме и их влияние на клеточные процессы. Знание этих классов белков является важной составляющей в изучении биохимии и биологии.
Видео:PROСТО О СЛОЖНОМ. Белки и их структуры. Биохимия №1Скачать

Ферменты
Функция ферментов заключается в ускорении скорости химических реакций, происходящих в клетках, при этом сами ферменты не изменяются и поэтому могут быть использованы многократно.
Ферменты классифицируются по типу реакции, которую они катализируют, также они могут быть разделены на несколько групп:
- Оксидоредуктазы — ферменты, участвующие в окислительно-восстановительных реакциях;
- Трансферазы — ферменты, переносящие функциональные группы между молекулами;
- Гидролазы — ферменты, разрушающие химические связи с помощью воды;
- Лиазы — ферменты, катализирующие разрыв химических связей без участия воды;
- Изомеразы — ферменты, которые изменяют конфигурацию молекулы без изменения ее структуры;
- Лигазы — ферменты, катализирующие образование новой химической связи;
Ферменты играют важную роль в пищеварении, регуляции обмена веществ, восстановительных процессах, синтезе биологически активных веществ и многих других процессах, необходимых для жизни организмов.
Видео:Белки | Биология 10 класс #8 | ИнфоурокСкачать

Антитела
Антитела представляют собой специфические белки, которые производятся иммунными клетками организма в ответ на введение антигена. Антитела играют ключевую роль в иммунной защите организма, образуя специфическую защитную реакцию на инфекцию и другие внешние воздействия.
Структура антител
Антитела состоят из двух одинаковых пар полипептидных цепей, которые связываются вместе и образуют Y-образную форму. Каждая цепь состоит из постоянных и переменных участков, которые обладают разной функциональностью и обеспечивают специфическую связь с антигенами.
Вариабельные (переменные) участки, расположенные на концах Y-образной структуры, отвечают за связывание с антигенами. Константные (неизменные) участки представляют собой основу антител и определяют присоединение других клеток иммунной системы для образования иммунного комплекса.
Классификация антител
Антитела классифицируются по различным признакам. Одним из основных критериев является их структурная организация. В зависимости от числа и типа цепей, которые образуют Y-образную форму, антитела могут относиться к разным классам, таким как IgG, IgA, IgM, IgD и IgE.
Кроме того, антитела могут быть классифицированы по способу действия, например, нейтрализующие или активирующие комплемент. Также существуют антитела, специфические для определенных антигенов или групп антигенов.
| Класс антитела | Функция |
|---|---|
| IgG | Основной класс антител, обеспечивает иммунитет после первичной инфекции |
| IgA | Присутствует в выделениях слизистых оболочек, защищает организм от инфекций |
| IgM | Первичный ответ на инфекцию, образуются в большом количестве |
| IgD | Роль в активации и дифференцировке B-лимфоцитов |
| IgE | Участвуют в аллергических реакциях, связаны с рецепторами на поверхности мастоцитов и базофилов |
Видео:Белки. Их свойства и функции. 8 класс.Скачать

Гормоны
Гормоны могут быть разделены на несколько классов в зависимости от их химического состава и структуры:
Белковые гормоны
Белковые гормоны состоят из аминокислот, связанных в цепочки. Примеры белковых гормонов включают инсулин, гормон роста и интерфероны. Они передают сигналы от клеток к клеткам через поверхностные рецепторы.
Стероидные гормоны
Стероидные гормоны синтезируются из холестерина и включают гормоны половых желез (эстрогены, прогестерон, тестостерон) и кортикостероиды (кортизол, альдостерон). Они проникают через клеточные мембраны и связываются с рецепторами внутри клетки, чтобы регулировать генную активность.
Гормоны играют важную роль в регуляции множества процессов в организме, таких как метаболизм, размножение, рост, иммунная функция и поведение. Их дисбаланс может привести к различным заболеваниям и состояниям, поэтому понимание классификации гормонов помогает в диагностике и лечении многих заболеваний.
Видео:Белки - виды аминокислот, суточная потребностьСкачать

Классификация белков по составу
Классификация белков по количеству аминокислот
Белки могут быть классифицированы по количеству аминокислотных остатков в своей структуре:
- Пептиды: молекулы, состоящие из 2-50 аминокислотных остатков;
- Олигопептиды: молекулы, состоящие из 50-100 аминокислотных остатков;
- Полипептиды: молекулы, состоящие из более 100 аминокислотных остатков;
- Белки: молекулы, состоящие из более 100 аминокислотных остатков;
Классификация белков по составу аминокислот
Белки также могут быть классифицированы по составу аминокислот, из которых они состоят. В зависимости от вида аминокислот, которые включаются в их состав, белки могут быть разделены на следующие группы:
- Белки с альфа-аминокислотами: такие белки состоят из стандартных альфа-аминокислот;
- Белки с модифицированными аминокислотами: такие белки содержат аминокислотные остатки, модифицированные химическими группами или замещены другими аминокислотами;
- Белки с нестандартными аминокислотами: такие белки содержат нестандартные аминокислотные остатки, которые отличаются от стандартных аминокислот;
- Белки с ковалентно связанными кофакторами: такие белки содержат ковалентно связанные неаминокислотные комоненты, называемые кофакторами. Кофакторы могут быть различными органическими молекулами, такими как витамины или их производные, и металлами;
Классификация белков по составу позволяет установить их структурные особенности и функциональное назначение, что важно для понимания их роли в живых организмах и применения их в биотехнологии и медицине.
Видео:Строение и функции белков.Скачать

Простые белки
Простые белки могут быть классифицированы по их аминокислотному составу. Например, некоторые простые белки состоят только из аминокислот глицина, аланина и пролина, их называют глицин-аланин-пролиновыми белками. Другие простые белки могут содержать только аминокислоты из определенной группы или иметь определенную последовательность аминокислот.
Простые белки могут выполнять различные функции в организме. Некоторые из них являются структурными компонентами клеток и тканей. Например, коллаген – это простой белок, который составляет основу соединительной ткани. Другие простые белки являются ферментами, которые участвуют в химических реакциях в организме. Еще одна группа простых белков – это антитела, которые играют важную роль в иммунной защите организма.
Простые белки могут быть также классифицированы по их структуре. Например, некоторые простые белки имеют линейную структуру, а другие – трехмерную. Линейные простые белки состоят из простых аминокислотных цепей, а трехмерные простые белки имеют определенную пространственную конфигурацию, образующую устойчивую структуру.
Простые белки играют важную роль в функционировании организма, и изучение их состава и структуры помогает углубить понимание многих биологических процессов. Белки в клетках выполняют множество различных функций, и каждая их группа имеет свои уникальные особенности и свойства, важные для жизнедеятельности организма.
Видео:БЕЛКИ: строение, функции, классификация, аминокислоты / БиохимияСкачать

Сложные белки
Сложные белки представляют собой белки, состоящие из нескольких подъединиц. Они образуются путем соединения двух или более простых белковых единиц, называемых подъединицами.
Подъединицы сложных белков могут быть одинаковыми или разными по структуре и функции. Они могут образовывать сложные белки различного типа, такие как гемоглобин, антитела и ферменты.
Состав и структура сложных белков могут быть очень разнообразными. Они могут содержать различные ионные группы, кофакторы, металлы и другие органические и неорганические соединения.
Связывание подъединиц в сложные белки происходит через различные типы взаимодействий, такие как гидрофобные, ионные и водородные связи. Эти взаимодействия обеспечивают стабильность и функциональность сложных белков.
| Примеры сложных белков | Описание |
|---|---|
| Гемоглобин | Сложный белок, содержащий 4 подъединицы: 2 альфа-глобина и 2 бета-глобина, связанные с группами гема. Гемоглобин отвечает за перенос кислорода в организме. |
| Антитела | Сложные белки, состоящие из тяжелых и легких цепей. Антитела играют ключевую роль в иммунной системе, опознавая и борясь с инфекционными веществами и другими антигенами. |
| Ферменты | Сложные белки, катализирующие химические реакции в организме. Они состоят из активного центра и различных подъединиц, необходимых для катализа. |
Сложные белки имеют большое значение для жизнедеятельности организмов. Их разнообразие и специализация позволяют выполнять множество различных функций, необходимых для поддержания жизни.
Видео:Биохимия. Классификация белков. Ч.1. Система классификации.Скачать

Нуклеопротеиды
Нуклеопротеиды состоят из двух основных компонентов: нуклеиновых кислот и белков. Нуклеиновые кислоты представлены в виде ДНК и РНК, которые содержат генетическую информацию. Белки же обеспечивают структурную целостность нуклеиновых кислот и способствуют их функционированию.
Существуют несколько типов нуклеопротеидов, включая хроматин, нуклеосомы и каркасные белки, такие как гистоны и протеины каркаса. Эти белки участвуют в организации и уплотнении генома, обеспечивая правильную активность генов.
Хроматин
Хроматин является основным компонентом ядра клетки и представляет собой комплексный образовательный узел, состоящий из ДНК, РНК и различных белковых компонентов. Этот нуклеопротеид играет важную роль в регуляции активности генов и сохранении генетической информации в клетке.
Нуклеосомы
Нуклеосомы представляют собой основные структурные единицы хроматина. Они состоят из восьмерки гистоновых белков, вокруг которых обмотана ДНК. Нуклеосомы обеспечивают компактность и структурную организацию хроматина, а также способствуют регуляции доступа к генетической информации.
Видео:Видеоурок по биологии "Белки"Скачать

Классификация белков по структуре
Белки могут быть классифицированы по их структуре, которая определена пространственным расположением аминокислотных остатков. В настоящее время существует несколько основных классов белков, которые отличаются своей структурой.
Простая структура
Простая структура белков характеризуется линейным пептидным цепочкой, состоящей из последовательности аминокислотных остатков. Такие белки называются гомополипептидами, так как состоят только из одного типа аминокислот. Примерами таких белков являются фиброин, кератин и коллаген.
Сложная структура
Сложная структура белков характеризуется наличием нескольких полипептидных цепей, которые связаны друг с другом по разным принципам. Такие белки могут содержать различные типы аминокислот и иметь разнообразные функции. Примерами таких белков являются гемоглобин, антитела и ферменты.
Для более детальной классификации белков по их структуре используется система, основанная на структурных мотивах и связующих элементах, таких как альфа-спирали, бета-складки и другие.
| Класс белков | Описание |
|---|---|
| Альфа-спиральные белки | Характеризуются наличием а-спиральной структуры, образованной поворотами полипептидной цепи вокруг своей оси. |
| Бета-складочные белки | Характеризуются наличием б-складочных структур, образованных клубочками из плоских строительных блоков. |
| Альфа+бета-протеины | Характеризуются наличием как а-спиральной, так и б-складочной структуры. |
| Мотивы | Характеризуются наличием определенных структурных узоров в аминокислотной последовательности белка. |
Классификация белков по их структуре помогает понять их функцию, взаимодействие с другими молекулами и свойства, что является ценной информацией в биологических и медицинских исследованиях.
Видео:Биология. 10 класс. Классификация белков по составу и по функциям /14.09.2020/Скачать

Мономерные белки
Мономерные белки могут быть разнообразными по своей длине и функциональности. Некоторые мономерные белки являются ферментами, которые катализируют химические реакции в организме. Другие мономерные белки выполняют структурные функции и являются строительными блоками клеток и тканей.
Структура мономерных белков
Структура мономерных белков обычно состоит из последовательности аминокислотных остатков, связанных пептидными связями. Аминокислотные остатки мономерных белков могут быть разнообразными, и их последовательность определяет форму и функцию белка.
Мономерные белки могут иметь различные уровни структуры, включая первичную, вторичную, третичную и кватерный структуры. Первичная структура определяется последовательностью аминокислотных остатков, вторичная — пространственной структурой а-спираль и п-слоев, третичная — трехмерной структурой всего белка, а кватерная — взаимным расположением нескольких мономерных белков.
Примеры мономерных белков
Примерами мономерных белков являются инсулин, гемоглобин, миозин, кератин и многие другие. Инсулин — гормон, регулирующий уровень сахара в крови, состоит из двух цепей, связанных дисульфидными мостиками и является мономерным белком.
Гемоглобин — белок, отвечающий за перенос кислорода в крови, состоит из двух альфа-цепей и двух бета-цепей, и также является мономерным белком. Кератин — структурный белок, образующий волосы, ногти, и кожу человека, также является мономерным белком.
Мономерные белки играют важную роль в функционировании организма и могут быть подвержены различным изменениям, включая мутации. Понимание структуры и функции мономерных белков является ключевым для понимания биологических процессов и разработки новых методов лечения различных заболеваний.
Видео:Виды белков в биологии #умскул_биология #жаннаказанская #умскул #егэ2023 #биологияСкачать
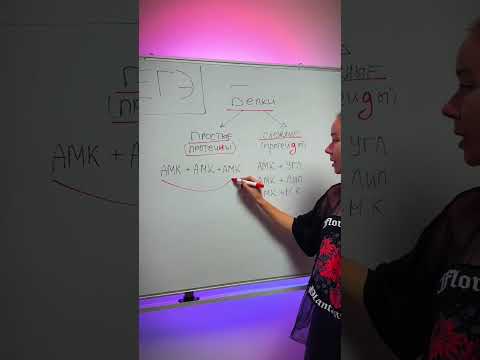
Олигомерные белки
Олигомерные белки представляют собой группу белков, состоящих из двух или более идентичных или различных субъединиц. Их структура отличается от структуры мономерных белков, которые состоят из одной субъединицы. Олигомерные белки могут образовываться как результат сборки нескольких идентичных подъединиц, так и из различных подъединиц.
Олигомерные белки играют важную роль в многих биологических процессах, таких как катализ химических реакций, передача сигналов в клетке, стабилизация структуры мембраны и участие в метаболических путях. Некоторые олигомерные белки могут взаимодействовать с другими молекулами и формировать более сложные структуры, например, комплексы с ДНК или РНК.
Одним из примеров олигомерных белков являются гемоглобин и миоглобин. Гемоглобин состоит из четырех субъединиц, которые связываются с кислородом и транспортируют его по организму. Миоглобин представляет собой мономерный белок, который связывает кислород в мышцах.
Структура олигомерных белков может быть различной и зависеть от взаимодействия субъединиц. Например, они могут формировать кольца, спирали, димеры или тетрамеры. Комбинируя различные типы субъединиц, олигомерные белки создают разнообразные функции и обеспечивают высокую универсальность и адаптивность в клеточных процессах и организмах в целом.
Видео:Функции белков. Видеоурок по биологии 10 классСкачать

Фиброзные белки
Структура фиброзных белков
Основными структурными элементами фиброзных белков являются аминокислоты глицин, пролин и гидроксипролин. Они образуют повторяющиеся мотивы, которые связываются друг с другом и образуют горизонтальные структуры.
Также для фиброзных белков характерны две другие структурные особенности. Во-первых, они обычно содержат высокую долю прочного связующего вещества – коллагена. Во-вторых, фиброзные белки как правило используются для создания волокнистых материалов и структур, что обеспечивает им дополнительную прочность и устойчивость.
Функции фиброзных белков
Главной функцией фиброзных белков является поддержка и укрепление структуры тканей. Они играют важную роль в формировании соединительной ткани, костей, хрящей и других структур организма. Кроме того, фиброзные белки участвуют в биологических процессах, связанных с перемещением и сокращением мышц, обеспечивая им прочность и эластичность.
Также некоторые фиброзные белки выполняют роль белков крови, передвигаясь по сосудам и участвуя в образовании тромбов – сгустков крови, необходимых для остановки кровотечений.
Важно отметить, что фиброзные белки имеют разное строение и выполняют различные функции. Например, коллагены взаимодействуют с другими белками и помогают создать каркас ткани, а эластин обеспечивает ей эластичность.
Видео:Структура белковСкачать

Классификация белков по полуразрушаемости
Полуразрушаемость белков – это свойство белковой молекулы быть частично разрушенной при работе с ней или при хранении. Белки обладают различной устойчивостью к воздействию различных факторов, таких как температура, pH, присутствие различных химических веществ и т.д.
В зависимости от своей полуразрушаемости белки классифицируются на несколько групп:
- Термолабильные белки – это белки, которые быстро разрушаются при повышении температуры. Высокая температура приводит к нарушению третичной и вторичной структуры белка, что ведет к потере его функциональности.
- Ацидолабильные белки – это белки, которые разрушаются в кислой среде или при низком pH. Кислая среда приводит к денатурации белков, что изменяет их структуру и устойчивость.
- Алкалолабильные белки – это белки, которые разрушаются в щелочной среде или при высоком pH. Щелочная среда также вызывает денатурацию белков и нарушение их структуры.
- Устойчивые белки – это белки, которые обладают высокой устойчивостью к различным факторам, таким как высокая температура, кислая или щелочная среда. Они сохраняют свою структуру и функциональность даже при сильном воздействии.
Знание полуразрушаемости белков позволяет лучше понять их свойства и использовать их в различных областях, таких как пищевая промышленность, медицина, косметология и другие.
Видео:10 класс - Биология - Строение и функции белков в клеткеСкачать

Лабильные белки
Лабильные белки могут претерпевать физические изменения, такие как фолдинг (складывание) и анфолдинг (раскладывание), а также химические модификации, включая фосфорилирование, гликозилирование и ацетилирование.
Изменения в структуре и активности лабильных белков часто связаны с различными биологическими процессами, такими как сигнальные пути, регуляция генной экспрессии, адаптация клетки к стрессовым условиям и многое другое.
Лабильные белки могут иметь важное значение в диагностике и лечении различных заболеваний, таких как рак, сердечно-сосудистые заболевания, нейродегенеративные заболевания и другие.
Примеры лабильных белков:
- Протеинкиназы — фосфорилируют другие белки, изменяя их активность и функцию.
- Белки-транскрипционные факторы — регулируют процессы транскрипции генов и могут быть фосфорилированы или гликозилированы.
- Хейн лабильный белок — участвует в процессах крови и может изменять свою активность в ответ на изменения в окружающей среде.
Изучение и понимание лабильных белков имеет важное значение для разработки новых методов диагностики и лечения различных заболеваний, а также для расширения нашего понимания основных принципов биохимии и биологии.
Видео:Клеточная мембрана: холестерин, белки-транспортеры, гликопротеины, гликолипидыСкачать

Стабильные белки
Одним из ключевых свойств стабильных белков является их высокая термостабильность. Это означает, что они могут выдерживать высокие температуры без потери своей функциональной активности. Такая устойчивость делает стабильные белки ценными для промышленности и медицины.
Кроме того, стабильные белки обладают высокой устойчивостью к кислотам, щелочам, солям и другим химическим веществам. Это позволяет им сохранять свою структуру и функцию даже при экстремальных условиях, таких как кислые или щелочные растворы, или наличие высоких концентраций солей.
Стабильные белки широко распространены в природе и играют важную роль в различных биологических процессах. Они могут быть найдены в различных организмах — от бактерий до человека. Примерами стабильных белков являются коллаген, кератин, гемоглобин и другие.
Изучение стабильных белков позволяет узнать больше о их уникальных свойствах и применить их в различных областях науки и технологии. Например, стабильные белки могут использоваться в качестве противораковых препаратов, а также в производстве пищевых добавок и промышленных материалов.
Важно отметить, что стабильность белков зависит от их структуры и последовательности аминокислот. Даже небольшие изменения в структуре могут привести к потере стабильности и функциональной активности.
Видео:Биохимия. Лекция 1. Аминокислоты, входящие в состав белков организма человека.Скачать

Протеиназоустойчивые белки
Протеиназы — это группа ферментов, отвечающих за расщепление белков на более мелкие фрагменты, путем гидролиза пептидных связей. Их действие может привести к денатурации и потере активности белков.
Протеиназоустойчивые белки могут играть важную роль в различных биологических процессах. Они могут участвовать в регуляции клеточного цикла, сигнальных путях, выживании клетки и других процессах.
Механизмы протеиназоустойчивости
Механизмы протеиназоустойчивости могут включать:
- Стабильную структуру — протеиназоустойчивые белки имеют хорошо сформированную структуру с прочными внутренними связями, что делает их более устойчивыми к денатурации.
- Повышенную гидрофобность — протеиназоустойчивые белки содержат повышенное количество гидрофобных аминокислот, которые укрепляют их структуру и предотвращают их денатурацию.
- Присутствие дополнительных связей — некоторые протеиназоустойчивые белки могут образовывать дополнительные связи, такие как сульфидные мостики или солевые мостики, что повышает их устойчивость.
Применение протеиназоустойчивых белков
Протеиназоустойчивые белки широко используются в различных областях, таких как биотехнология, фармацевтика и пищевая промышленность. Они могут быть использованы для создания стабильных белковых препаратов, разработки новых лекарственных средств и улучшения структурных и функциональных свойств пищевых продуктов.
В заключении, протеиназоустойчивые белки являются важным классом белков, которые обладают высокой устойчивостью к протеолитическим ферментам. Они могут играть важную роль в различных биологических процессах и имеют широкий спектр применений в различных отраслях науки и промышленности.
📹 Видео
Белки. Видеоурок 6. Биология 9 классСкачать

§ 7 Состав и строение белковСкачать
