Растворы играют важную роль в химии и имеют широкое применение в нашей повседневной жизни. Они представляют собой гомогенные системы, состоящие из двух или более компонентов – растворителя и растворенного вещества. Растворы могут быть различных типов, каждый из которых имеет свои особенности и свойства.
Первый тип растворов – газовые растворы. Они образуются, когда газ растворяется в жидкости или другом газе. Примером такого раствора является газообразный кислород, растворенный в воде, что позволяет рыбам дышать под водой. Газовые растворы также играют роль в аэрозолях и газовых баллонах.
Второй тип растворов – жидкие растворы. В них жидкость выступает в роли растворителя и растворенного вещества. Такие растворы широко применяются в химической промышленности, фармацевтике, пищевой промышленности и других отраслях. Например, алкогольные напитки, лекарства и красители — все эти продукты представляют собой жидкие растворы.
Третий тип растворов – твердые растворы. Они образуются, когда твердое вещество растворяется в другой твердой матрице. Например, сплавы металлов являются твердыми растворами, где один металл растворяется в другом. Твердые растворы могут иметь уникальные свойства и использоваться для создания различных сплавов и металлических материалов с необходимыми характеристиками.
В итоге, знание различных видов растворов и их свойств имеет важное значение как для науки, так и для практического применения. Это позволяет более эффективно использовать растворы в различных сферах нашей жизни.
- Виды растворов:
- Физические растворы:
- Определение и свойства:
- Примеры и использование:
- Химические растворы:
- Определение и свойства:
- Примеры и использование:
- Электролитические растворы:
- Определение и свойства:
- Примеры и использование:
- Интерметаллические растворы:
- Определение и свойства:
- Примеры и использование:
- Расплавы:
- Определение и свойства:
- Примеры и использование:
- Газовые растворы:
- Определение и свойства:
- Примеры и использование:
- Коллоидные растворы:
- Определение и свойства:
- Примеры и использование:
- Суспензии:
- Определение и свойства:
- Примеры и использование:
- Эмульсии:
- Определение и свойства:
- 📸 Видео
Видео:Способы выражения концентрации растворов. 8 класс.Скачать

Виды растворов:
В зависимости от состава и свойств растворенных веществ, выделяют следующие виды растворов:
- Гомогенные растворы – растворы, в которых растворенные вещества полностью смешиваются и образуют однородную систему. Примером гомогенного раствора является сахарный раствор, вода с солью или спирт
- Гетерогенные растворы – растворы, в которых растворенные вещества не полностью смешиваются и образуют неоднородную систему. Примером гетерогенного раствора является глиняный раствор или мутная вода с песком
Также растворы можно классифицировать по типам растворителей:
- Водные растворы – растворы, в которых растворителем выступает вода. Это наиболее распространенный тип растворов, так как вода является универсальным растворителем и способна растворять множество веществ
- Неводные растворы – растворы, в которых растворителем выступает вещество, отличное от воды. Примерами неводных растворов являются кислотные растворы (растворы кислот в спирте или эфире), алкогольные растворы (растворы алкоголей в воде или других спиртах) и др.
Видео:Растворы. 8 класс.Скачать

Физические растворы:
В физических растворах молекулы растворителя окружают молекулы растворенного вещества, образуя взаимопроникающие друг в друга сферы смешения. Это позволяет растворенным веществам находиться в однородном состоянии и отсутствуют механические и химические изменения.
Одним из примеров физического раствора является раствор соли в воде. В данном случае вода выступает в роли растворителя, а соль — в роли растворенного вещества. Молекулы воды окружают и разделяют ионы соли, образуя гомогенную смесь. Раствор соли в воде сохраняет свои физические свойства и не может считаться отдельным веществом.
Физические растворы широко используются в различных областях, включая химию, медицину, пищевую промышленность и другие. Они играют важную роль в процессах, таких как диффузия, осмос, растворение и др.
Определение и свойства:
Основные свойства растворов включают:
- Состав: раствор может быть одно- или многокомпонентным в зависимости от числа веществ, которые входят в его состав.
- Концентрация: определяет количество растворимого вещества, находящегося в растворе, и может быть выражена в процентах, молях или весе.
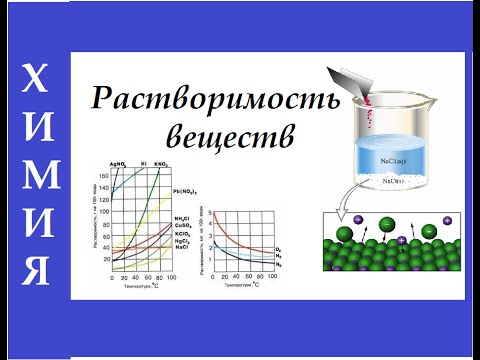
- Растворимость: это способность вещества растворяться в определенном растворителе при определенных условиях температуры и давления.
- Физические свойства: раствор может иметь свойства, отличные от свойств растворимого вещества и растворителя, такие как плотность, вязкость и т.д.
- Химические свойства: реакционная способность раствора может отличаться от растворимого вещества и растворителя, что позволяет проводить химические реакции в растворах.
Понимание определения и свойств растворов является важным для понимания химических процессов и их применения в различных областях, таких как промышленность, медицина и научные исследования.
Примеры и использование:
Пример 1: Раствор соли. При растворении обычной кухонной соли (хлорида натрия) в воде, образуется прозрачный раствор. Такой раствор можно использовать для приготовления пищи, при уколах и полосканиях.
Пример 2: Раствор кислоты. Раствор серной кислоты имеет кислый pH и может использоваться в лабораторных и промышленных целях для различных химических реакций, а также для очистки и дезинфекции поверхностей.
Пример 3: Раствор щелочи. Раствор гидроксида натрия (щелочи) обладает щелочными свойствами и может использоваться для нейтрализации кислых растворов, в качестве очистки и дезинфекции, а также в производстве мыла и других товаров.
Пример 4: Раствор оксида. Раствор оксида железа III образует красноватый цвет и может использоваться в качестве пигмента для красок и косметики, а также для окрашивания стекла и керамики.
Пример 5: Раствор специального солевого состава. Некоторые промышленные растворы могут содержать специальные солевые составы, которые используются для различных процессов, таких как гальваническое покрытие, электролиз и др.
Видео:Растворимость веществ. Виды растворов. Насыщенность растворов.Скачать
Химические растворы:
В химии существует несколько типов химических растворов, включая ионные растворы, молекулярные растворы и коллоидные растворы.
Ионные растворы образуются, когда ионы растворяемого вещества полностью или частично растворяются в растворителе. В результате образуются положительно и отрицательно заряженные ионы, которые перемещаются свободно в растворе. Примером ионного раствора является NaCl, где ионы Na+ и Cl- растворены в воде.
Молекулярные растворы состоят из отдельных молекул, растворенных в растворителе без образования ионов. В таких растворах молекулы полностью сохраняют свою структуру и сами потенциально могут образовывать взаимодействия. Примером молекулярного раствора является сахар, который можно растворить в воде.
Коллоидные растворы являются особым типом растворов, в которых частицы растворенного вещества имеют размеры в диапазоне от 1 до 1000 нанометров. Такие растворы не являются ни ионными, ни молекулярными, поэтому обладают специальными свойствами. Примером коллоидного раствора является молоко.
Химические растворы играют важную роль в химических процессах и имеют широкое применение в нашей повседневной жизни. Они используются для приготовления и обработки пищи, промышленных процессов, медицинских препаратов и многих других целей.
Определение и свойства:
Раствором называют однородную систему, образованную двумя или более веществами, из которых одно, называемое растворителем, присутствует в большем количестве, а другое, называемое растворяемым веществом, находится в меньшем количестве и представляет собой мельчайшие частицы (молекулы, ионы или атомы).
Основные свойства растворов:
| Свойство | Описание |
|---|---|
| Прозрачность | Растворы могут быть как прозрачными, так и мутными в зависимости от того, содержатся ли в них взвеси или нет. |
| Растворимость | Растворимость определяет количество растворяемого вещества, которое можно растворить в определенном количестве растворителя при определенных условиях. |
| Концентрация | Концентрация раствора определяет количество растворенного вещества, содержащегося в единице объема или массы растворителя. |
| Электропроводность | Некоторые растворы обладают способностью проводить электрический ток, такие растворы называются электролитическими. |
| Температурный коэффициент растворимости | Коэффициент растворимости определяет зависимость растворимости вещества от температуры. |
| Фазовые свойства | Растворы могут находиться в различных фазовых состояниях, таких как газообразные, жидкие или твердые. |
Примеры и использование:
Растворы играют важную роль в различных областях науки и промышленности. Вот несколько примеров их использования:
Медицина:
Различные лекарственные препараты часто используются в виде растворов для удобного введения в организм. Например, инъекции и капельницы используются для подачи растворов лекарств непосредственно в вену или мышцы пациента.
Химическая промышленность:
Растворы широко применяются в химической промышленности для различных процессов. Например, соли растворяются в воде для получения электролитов, используемых в аккумуляторах и электролитических процессах.
Пищевая промышленность:
В пищевой промышленности растворы используются для различных целей, включая консервирование, пищевых добавок и ароматизаторов. Например, солевые растворы используются для консервирования овощей и мяса.
Фотография:
В химическом процессе фотографии, растворы используются для обработки фотографической пленки и бумаги, чтобы создать изображения. Растворы также используются для тонирования и фиксации фотографий.
Это всего лишь несколько примеров использования растворов, которые демонстрируют их важность и разнообразие в различных областях. Растворы являются важными инструментами, которые позволяют реализовывать множество химических, медицинских и промышленных процессов.
Видео:Все про бетон: состав, марки, способы примененияСкачать

Электролитические растворы:
В электролитических растворах присутствуют положительные (катионы) и отрицательные (анионы) ионы, которые образуются в результате диссоциации электролита.
Важной особенностью электролитических растворов является то, что они способны проводить электрический ток, так как в составе раствора присутствуют заряженные ионы. Электролитическая проводимость раствора зависит от концентрации ионов.
Примеры электролитических растворов:
- Соляная кислота (HCl) в воде;
- Калий гидроксид (KOH) в воде;
- Магний сульфат (MgSO4) в воде;
- Калия бромид (KBr) в воде.
Электролитические растворы играют важную роль в химических реакциях и являются основой для проведения электролиза, электрохимических процессов и других интересных явлений.
Определение и свойства:
Свойства растворов могут значительно отличаться от свойств исходных веществ. Они зависят от концентрации растворов и могут изменяться при изменении физических или химических условий.
Одним из основных свойств растворов является прозрачность. В отличие от суспензий и эмульсий, растворы обладают прозрачностью и не отделяются на видимые компоненты.
Кроме того, растворы могут быть однородными или неоднородными. Однородные растворы характеризуются равномерным распределением солюта в сольвенте, в то время как в неоднородных растворах солют может быть неравномерно распределен в объеме сольвента.
Еще одним важным свойством растворов является их концентрация. Концентрация раствора определяется отношением количества солюта к объему сольвента. Она может быть выражена в различных единицах, таких как моль на литр, проценты или молярность.
Различные растворы могут обладать различными физическими и химическими свойствами, такими как плотность, вязкость, теплопроводность и реакционная способность. Эти свойства могут быть использованы для определения и анализа состава растворов.
Примеры и использование:
1. Вода как универсальный растворитель:
Вода является одним из самых распространенных растворителей. Она используется для приготовления различных растворов, таких как наборы для инъекций, лекарства, красители для красок и многое другое. Также вода служит основным растворителем во многих лабораторных экспериментах.
2. Сольной раствор:
Соли растворяются в воде и образуют солевые растворы. Такие растворы используются в пищевой промышленности для консервации, соления, производства сыров и так далее. Они также широко используются в медицине, в процессе регидратации при обезвоживании.
3. Растворы кислот и щелочей:
Растворы кислот и щелочей используются в химических процессах, в лабораториях и в промышленности. Кислоты и щелочи могут быть использованы для регулирования pH, очистки и обеззараживания, процессов катализа и т. д.
4. Растворы растворимых солей:
Растворы растворимых солей используются в аналитической химии для процессов экстракции, разделения и определения различных соединений. Также они могут быть использованы в процессе выделения металлов из их руды.
Важно отметить, что правильное использование растворов является ключевым фактором для их эффективного применения и безопасности.
Видео:ЕСТЕСТВОЗНАНИЕ 6 КЛАСС ВИДЫ РАСТВОРОВ И СРЕДЫ В НИХСкачать

Интерметаллические растворы:
Интерметаллические растворы обладают рядом уникальных свойств. Во-первых, они могут образовывать сплавы с новыми физическими и химическими свойствами. Это может привести к появлению новых материалов с улучшенными механическими или электрическими характеристиками.
Кроме того, интерметаллические растворы обладают высокой термической и химической стабильностью. Они могут выдерживать высокие температуры и сопротивлять окислению и коррозии. Это делает их полезными для использования в различных технических и промышленных приложениях.
Интерметаллические растворы также часто обладают особыми магнитными свойствами. Например, они могут быть ферромагнитными или антиферромагнитными, что отличает их от обычных металлов.
Кроме того, интерметаллические растворы могут иметь специфическую структуру, такую как кристаллическая решетка или аморфная структура. Это может влиять на их механические, электрические и оптические свойства.
Интерметаллические растворы имеют широкий спектр применений. Они используются в производстве сплавов, катализаторов, электроники, магнитных материалов, а также в других отраслях промышленности и научных исследований.
Определение и свойства:
Свойства растворов определяются их составом и концентрацией. Основные свойства растворов включают:
- Растворимость — способность вещества растворяться в другом веществе.
- Степень растворения — количество растворенного вещества в единице объема растворителя.
- Концентрация — отношение массы растворенного вещества к объему растворителя.
- Вязкость — сопротивление раствора течению.
- Плотность — масса раствора, содержащегося в единице объема.
- Точка замерзания — температура, при которой раствор начинает замерзать.
- Точка кипения — температура, при которой раствор начинает кипеть.
- Показатель преломления — отношение скорости света в вакууме к скорости света в растворе.
Свойства растворов могут изменяться в зависимости от концентрации и температуры. Например, растворимость многих веществ увеличивается с увеличением температуры, а точка замерзания и кипения растворов зависят от их состава.
Примеры и использование:
1. Солевой раствор: Один из самых распространенных и широко используемых типов растворов. Примером такого раствора может быть раствор кухонной соли в воде. Солевые растворы используются во многих сферах, включая кулинарию, медицину, химическую промышленность.
2. Кислотный раствор: Раствор, содержащий кислоту в растворителе. Примером может служить раствор серной кислоты в воде. Кислотные растворы используются в химическом анализе, процессах нейтрализации, металлургии и других отраслях.
3. Щелочной раствор: Раствор, содержащий щелочь (основание) в растворителе. Примером может служить раствор гидроксида натрия в воде. Щелочные растворы используются в качестве моющих средств, в производстве бумаги, стекла, мыла и дрогих отраслях.
4. Нейтральный раствор: Раствор, имеющий pH около 7, который является средним значением между кислотным и щелочным растворами. Примером может служить раствор натрия хлорида (NaCl) в воде. Нейтральные растворы широко используются в химическом анализе и других областях.
5. Раствор солей металлов: Раствор, содержащий соли металлов. Примером может служить раствор серебряного нитрата (AgNO3) в воде. Растворы солей металлов используются в химической промышленности, фотографии, электролитических процессах.
Использование различных типов растворов зависит от конкретных потребностей и целей. Знание свойств и особенностей этих растворов помогает в осуществлении различных процессов и решении задач в разных областях науки, техники и промышленности.
Видео:Количественные характеристики растворов. Растворимость | Химия ЕГЭ, ЦТСкачать

Расплавы:
Основной характеристикой расплавов является температура плавления вещества, которое представляет собой наименьшую температуру, при которой твердое вещество может перейти в жидкое состояние. Помимо температуры плавления, для расплавов также важны такие свойства, как вязкость, плотность и поверхностное натяжение.
Расплавы могут быть однокомпонентными, когда они содержат только одно вещество, или многокомпонентными, когда в их составе присутствуют несколько веществ. Многокомпонентные расплавы могут образовывать смеси в различных пропорциях, что позволяет получать разнообразные свойства и химические составы.
Использование расплавов в различных отраслях обусловлено их свойствами. Например, расплавы могут обладать высокой термической и электрической проводимостью, что делает их полезными для изготовления проводов и электронных компонентов. Кроме того, некоторые расплавы обладают специфическими химическими свойствами, такими, как кислотность или щелочность, что позволяет использовать их в различных процессах химической обработки.
Однако, использование расплавов также может быть связано с определенными проблемами и ограничениями. Например, высокая температура плавления некоторых веществ может создавать трудности при их обработке. Кроме того, некоторые расплавы являются токсичными или опасными для окружающей среды, что требует особых мер предосторожности при их использовании.
Определение и свойства:
Основные свойства растворов:
| Свойство | Описание |
|---|---|
| Однородность | Растворы являются однородными системами, то есть имеют однородное составление по своим свойствам и составу в разных точках объема. |
| Прозрачность | Большинство растворов прозрачны и пропускают свет. Однако некоторые растворы могут быть мутными или иметь опалесцентный вид. |
| Проницаемость | Растворы обладают способностью проникать через мембраны и фильтры в процессе фильтрации или осмотра. |
| Вязкость | Растворы могут обладать высокой или низкой вязкостью в зависимости от свойств растворителя и растворенного вещества. |
| Электропроводность | Растворы, содержащие электролиты, способны проводить электрический ток. |
| Теплопроводность | Растворы способны передавать тепло от одной точки к другой. |
Эти свойства растворов обусловлены особенностями взаимодействия молекул растворенных веществ и растворителя.
Примеры и использование:
Растворы играют важную роль в различных областях нашей жизни. Вот несколько примеров их использования:
1. Медицина и фармакология: Врачи часто используют растворы для внутривенного вливания лекарств, чтобы достичь быстрого и эффективного эффекта. Также растворы используются для приготовления различных медицинских препаратов и растворов для инъекций.
2. Химическая промышленность: Растворы широко применяются в химической промышленности для синтеза различных химических соединений. Кроме того, они используются для очистки и обработки различных материалов.
3. Пищевая промышленность: В пищевой промышленности растворы используются для приготовления различных продуктов, таких как соки, напитки, соусы и консервы. Они также используются для консервирования пищевых продуктов и добавления ароматизаторов и красителей.
4. Электролиты: Растворы электролитов играют важную роль в электролитических процессах, таких как электролиз, гальванические элементы и аккумуляторы. Они также используются для поддержания электролитического баланса в организме и для проведения различных химических экспериментов.
5. Домашняя химия: Растворы используются в бытовых условиях для приготовления различных средств ухода за домом, таких как моющие средства, отбеливатели и дезинфицирующие средства. Они также используются для очистки и обработки поверхностей в домашних условиях.
Это только некоторые из множества способов использования растворов. Они широко применяются во всем мире и играют важную роль в нашей повседневной жизни.
Видео:Типы буровых растворов и соответствующих реагентовСкачать

Газовые растворы:
Газовые растворы обладают рядом особенностей. Одна из них — газовое давление. В газовых растворах часть газа переходит в газовую фазу, создавая определенное давление. Это явление называется парциальным давлением.
Газовые растворы также характеризуются понятием растворимости. Растворимость газа в жидкости зависит от физических условий, таких как температура и давление. Чем выше температура, тем меньше газ способен растворяться в жидкости. При повышении давления растворимость газа увеличивается.
Одной из наиболее известных форм газовых растворов является аэрозоль. Аэрозоли — это газовые растворы, в которых мельчайшие частицы жидкости или твердого вещества распространены в газовой среде. Примерами аэрозолей являются туман, дым и пена.
Газовые растворы играют важную роль в природе и промышленности. Например, в атмосфере Земли присутствуют газовые растворы, такие как кислород, азот и углекислый газ. В медицине газовые растворы используются для проведения анализов и лечения различных заболеваний.
Определение и свойства:
Основными типами растворов являются понятия растворимости и концентрации. Растворимость – это максимальное количество вещества, которое может раствориться в данной температуре и данном количестве растворителя. Концентрация – это отношение массы растворенного вещества к объему растворителя.
Свойства растворов включают такие характеристики, как прозрачность, цветность, вязкость, плотность и т.д. Они могут быть различными в зависимости от конкретного раствора и его состава. Также растворы могут обладать электролитическими свойствами, то есть быть проводниками электричества.
Примеры и использование:
Растворы играют важную роль во многих сферах нашей жизни. Некоторые из примеров использования растворов:
Медицина: Растворы используются для подачи лекарственных препаратов в организм, например, в виде инъекций или капельниц. Они также могут применяться для приготовления антисептических растворов для обработки ран и ожогов.
Химическая промышленность: Растворы широко применяются в химической промышленности для синтеза различных веществ, регулирования pH растворов, очистки и удаления загрязнений.
Пищевая промышленность: Растворы используются для консервирования пищевых продуктов, регулирования вкуса и текстуры, а также для процессов ферментации.
Электроника: Растворы применяются в процессе производства электронных компонентов, таких как полупроводники и печатные платы, для очистки поверхности от загрязнений и регулирования проводимости.
Бытовые цели: Растворы используются в бытовых целях, например, для приготовления пищи, очистки поверхностей и стирки одежды.
Растворы являются неотъемлемой частью нашей жизни и находят применение во многих областях. Они обладают различными свойствами, которые делают их полезными для конкретных задач. Понимание основных типов растворов и их свойств позволяет использовать их с эффективностью и безопасностью.
Видео:Типы Химических Связей — Как определять Вид Химической Связи? Химия 9 классСкачать

Коллоидные растворы:
Одно из основных свойств коллоидных растворов — это опалесценция или мутность, которая проявляется в виде изменения цвета и преломления света в растворе. При взаимодействии коллоидных частиц с световым излучением происходит рассеяние света, что придает раствору характерный вид.
Коллоидные растворы часто образуются при взаимодействии двух веществ — дисперсной фазы и диспергирующей среды. Дисперсная фаза представляет собой частицы, которые остаются в растворе и не оседают. Диспергирующая среда служит для поддержания частиц в состоянии равновесия, предотвращая их оседание.
В коллоидных растворах дисперсная фаза может быть как твердой, так и жидкой. Так, в жидком коллоидном растворе взвешены мельчайшие капли жидкости, в то время как в твердом коллоидном растворе мельчайшие частицы твердого вещества рассеяны в другом веществе.
Коллоидные растворы также могут обладать некоторой электрической зарядностью. Это явление называется коллоидная дисперсия. Заряд коллоидных частиц может быть положительным, отрицательным или нейтральным, и зависит от химической природы взаимодействующих веществ.
Коллоидные растворы широко применяются в различных отраслях науки и техники. Они используются в медицине для создания лекарственных форм, в пищевой промышленности для придания продуктам определенных текстурных и вкусовых свойств, а также в косметической промышленности для производства кремов и лосьонов.
Определение и свойства:
Основные свойства растворов:
| Прозрачность | Растворы могут быть прозрачными, то есть пропускающими свет, или мутными, когда они содержат взвешенные частицы. |
| Растворимость | Растворимость – это способность вещества растворяться в другом веществе. Она зависит от природы вещества и температуры. |
| Концентрация | Концентрация раствора характеризует количество растворенного в нем вещества, выраженное в относительных или абсолютных единицах. |
| Фазовый состав | Растворы могут быть однофазными или многофазными, в зависимости от числа компонентов, их растворимости и условий среды. |
| Электрохимические свойства | Многие растворы проявляют электролитическую проводимость и могут быть классифицированы как электролиты или непроводники. |
Примеры и использование:
Растворы могут быть использованы для различных целей в разных областях науки и промышленности. Вот несколько примеров их использования:
| Область | Пример использования |
|---|---|
| Медицина | Инъекции и капельницы с лекарственными растворами для лечения заболеваний и облегчения симптомов. |
| Химия | Подготовка химических реакций, включая реакции в лабораторных условиях и промышленных процессах. |
| Пищевая промышленность | Разведение и приготовление пищевых продуктов, например, приготовление сиропов и соусов. |
| Аграрная наука | Применение удобрений и пестицидов в сельском хозяйстве для повышения урожайности и защиты растений от вредителей. |
| Электроника | Передача сигналов и электролитические растворы в батареях и аккумуляторах для генерации электричества. |
Это лишь некоторые примеры использования растворов в различных областях. Их универсальность и разнообразие делают растворы неотъемлемой частью нашей повседневной жизни.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Суспензии:
Суспензии широко применяются в медицине, фармацевтике, пищевой промышленности и других отраслях. Они могут использоваться для создания лекарственных препаратов, красителей, вкусовых добавок и других продуктов.
Основными свойствами суспензий являются:
- Распределение частиц: в суспензиях твердые частицы распределены неравномерно, что может привести к образованию осадка. Чтобы предотвратить это, частицы должны быть стабилизированы и равномерно распределены.
- Стабильность: суспензии могут быть стабилизированы с помощью добавления стабилизирующих веществ, которые предотвращают оседание частиц.
- Вязкость: суспензии могут быть более вязкими, чем другие типы растворов, из-за наличия твердых частиц.
- Оптические свойства: суспензии могут иметь различные оптические свойства в зависимости от размера и формы частиц.
Суспензии обладают широким спектром применений, и их свойства могут быть разными в зависимости от их состава и цели использования. Изучение и контроль свойств суспензий играют важную роль в различных областях науки и промышленности.
Определение и свойства:
Основные типы растворов:
- Водные растворы — растворы, где в качестве растворителя используется вода. Они широко распространены и имеют важное значение в жизни всех организмов на Земле.
- Неорганические растворы — растворы, в которых растворитель и растворимое вещество являются неорганическими соединениями. Примерами могут служить растворы кислот, щелочей и солей.
- Органические растворы — растворы, где растворителем и растворимым веществом являются органические соединения. Они находят широкое применение в химической промышленности и жизни человека.
- Газовые растворы — это растворы, в которых растворитель и растворимое вещество находятся в газообразном состоянии. Примерами могут служить растворы кислорода или двуокиси углерода в воде.
Основные свойства растворов:
- Прозрачность — растворы могут быть прозрачными, тогда как нерастворимые вещества обычно являются мутными или имеют некоторую видимость.
- Электропроводность — некоторые растворы, такие как соли, кислоты и щелочи, обладают способностью проводить электрический ток, потому что они диссоциируют на ионы в воде.
- Теплопроводность — растворы обычно имеют более высокую теплопроводность по сравнению с растворимыми веществами.
- Плотность — растворы могут иметь более высокую или более низкую плотность по сравнению с растворимыми веществами.
- Устойчивость — растворы могут быть стабильными или нестабильными в зависимости от химических свойств растворимых веществ.
Примеры и использование:
1. Растворы солей:
Примеры: раствор натрия хлорида (NaCl), раствор серной кислоты (H2SO4), раствор калия нитрата (KNO3).
Использование: растворы солей широко применяются в химической промышленности, медицине, сельском хозяйстве и других отраслях. Например, раствор натрия хлорида используется для приготовления физиологического раствора, а раствор калия нитрата – в сельском хозяйстве в качестве удобрения.
2. Растворы кислот:
Примеры: раствор серной кислоты (H2SO4), раствор соляной кислоты (HCl), раствор уксусной кислоты (CH3COOH).
Использование: растворы кислот широко используются в химической промышленности, лабораторных исследованиях, медицине и других областях. Например, раствор соляной кислоты применяется для регулировки pH в бассейнах, а раствор уксусной кислоты используется в кулинарии для консервации пищевых продуктов.
3. Растворы щелочей:
Примеры: раствор гидроксида натрия (NaOH), раствор гидроксида калия (KOH), раствор аммиака (NH3).
Использование: растворы щелочей находят применение в различных отраслях, таких как химическая промышленность, горное дело, строительство и т.д. Например, раствор гидроксида натрия используется в мыловарении, а раствор аммиака используется в процессе получения удобрений.
Видео:Классификация и типы буровых растворов и реагентов для регулирования их свойств.Скачать

Эмульсии:
В эмульсиях молекулы дисперсной фазы (жидкости, которая образует капли) окружены молекулами непрерывной фазы, образуя структуру, в которой капли дисперсной фазы равномерно распределены в непрерывной фазе. При этом капли не соединяются между собой и не оседают из-за действия поверхностно-активных веществ, называемых эмульгаторами.
Эмульсии имеют ряд свойств, которые делают их полезными и востребованными в различных областях промышленности и научных исследований. Они могут быть стабильными и неустойчивыми, а также являться жидкими или наполовину твердыми.
Существуют три основных типа эмульсий:
- Масло в воде (М/В) эмульсии: в этом типе эмульсий масло является дисперсной фазой, а вода — непрерывной фазой. Такие эмульсии являются стабильными и используются в производстве молочных продуктов, косметике и фармацевтической промышленности.
- Вода в масле (В/М) эмульсии: в этом типе эмульсий вода является дисперсной фазой, а масло — непрерывной фазой. Такие эмульсии обычно являются нестабильными и используются в производстве масел и кремов для увлажнения кожи.
- Масло в масле (М/М) эмульсии: в этом типе эмульсий два различных вида масла образуют дисперсную и непрерывную фазу. Такие эмульсии используются в пищевой промышленности для создания маргарина и других жировых продуктов.
Эмульсии играют важную роль во многих отраслях промышленности, включая пищевую, фармацевтическую и косметическую промышленность. Они обеспечивают гладкое и однородное распределение активных компонентов, улучшают стабильность и хранение продукта.
Определение и свойства:
Основными свойствами растворов являются концентрация, прозрачность и физические или химические свойства растворяемых веществ.
Концентрация раствора определяет количество растворенного вещества, приходящегося на единицу объема или массы раствора. Она может быть выражена в различных единицах измерения, например, в молях, процентах или граммах на литр.
Прозрачность раствора определяется способностью пропускать свет. Прозрачность может быть разной степени – от полностью прозрачного до полностью непрозрачного раствора.
Физические свойства растворов, такие как плотность, вязкость и теплопроводность, могут отличаться от свойств растворимого вещества и растворителя.
Химические свойства растворов определяют способность проводить химические реакции, например, образование осадка при взаимодействии двух растворов.
📸 Видео
ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Математика это не ИсламСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Виды штукатурки Какие бывают и для каких работ используют все по умуСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Степень электролитической диссоциации. Сильные и слабые электролиты. 9 класс.Скачать

Химия 8 Растворы Растворимость веществСкачать

Сперматозоид-чемпион | наглядно показано оплодотворениеСкачать

Приготовление раствора с заданной концентрациейСкачать

Буферные растворы. 1 часть. 11 класс.Скачать
