Углерод – один из наиболее распространенных элементов на Земле, и его уникальные свойства и возможности сделали его основой для многих органических соединений. Благодаря своей способности образовывать многочисленные связи с другими элементами, углерод образует большое количество различных соединений, из которых состоит самая большая группа химических соединений – органические соединения.
Углеродные соединения делятся на несколько классов в зависимости от степени окисления углерода и типа связей, которые он формирует. В основе классификации углеродных соединений лежит различие между наличием одинарных, двойных и тройных связей, а также присутствием функциональных групп, таких как карбоксильные группы и аминогруппы.
Самый простой тип углеродных соединений – алканы – представляет собой насыщенные углеводороды, в которых атомы углерода связаны одиночными связями. Алкены содержат двойные связи между атомами углерода, алкины – тройные связи, делая их более реакционноспособными и удобными для синтеза других химических соединений.
Карбонильные соединения, такие как альдегиды и кетоны, содержат функциональную группу карбонильного атома, который соединен либо с водородом, либо с карбонильной группой. Органические кислоты – это карбоксильные соединения, у которых карбонильная группа связана с гидроксильной группой. Амины – это соединения, содержащие аминогруппу, которая связана с углеродной цепью.
- Подраздел 1.1: Определение углеродов
- Подраздел 1.1.1: Основные свойства углеродов
- Подраздел 1.1.2: Важность углеродов в природе
- Подраздел 1.2: Типы углеродных соединений
- Подраздел 1.2.1: Атомарные углеродные соединения
- Подраздел 1.2.2: Молекулярные углеродные соединения
- Раздел 2: Способы классификации углеродов
- Подраздел 2.1: Классификация углеродов по способу связи атомов
- Подраздел 2.1.1: Насыщенные углеродные соединения
- Подраздел 2.1.2: Ненасыщенные углеродные соединения
- Подраздел 2.2: Классификация углеродов по структуре
- Подраздел 2.2.1: Ациклические углеродные соединения
- Подраздел 2.2.2: Циклические углеродные соединения
- Раздел 3: Основные свойства углеродов
- Подраздел 3.1: Химические свойства углеродов
- Подраздел 3.1.1: Способность к образованию связей
- Подраздел 3.1.2: Влияние окружающей среды на реактивность
- Подраздел 3.2: Физические свойства углеродов
- Подраздел 3.2.1: Температурные свойства углеродов
- Подраздел 3.2.2: Электрофизические свойства углеродов
- 🔥 Видео
Видео:Химия. 9 класс (Урок№17 - Углерод. Аллотропные модификации углерода.Химические свойства. Адсорбция.)Скачать

Подраздел 1.1: Определение углеродов
Углероды имеют уникальную способность образовывать длинные цепочки и кольца атомов, что делает их основой для образования сложных молекул. Они могут образовывать одинарные, двойные и тройные связи с другими атомами, образуя разнообразные химические соединения.
Углероды также обладают свойствами каталитической активности, что означает, что они способны ускорять химические реакции без участия в самих реакциях. Это делает углероды важными компонентами в катализаторах, применяемых в промышленных процессах.
Определение углеродов включает не только их химические свойства, но и их физические свойства, такие как точка плавления и кипения, теплопроводность и электропроводность. Углероды могут существовать в различных формах, включая алмазы, графит, углеродные нанотрубки и графен, каждая из которых обладает уникальными свойствами и имеет свое применение.
Подраздел 1.1.1: Основные свойства углеродов
Одно из основных свойств углерода – его способность образовывать длинные цепочки, из которых строятся органические молекулы. Это свойство позволяет углероду образовывать различные структуры и обуславливает многообразие органических соединений.
Углеродные связи представляют собой ковалентные связи между атомами углерода. Ковалентная связь образуется при обмене электронами между атомами, обеспечивая стабильность молекулы.
Способность катенации – это способность углерода образовывать связи с другими атомами углерода, образуя длинные цепочки. Такие цепочки могут быть прямыми, разветвленными или закольцованными.
Углероды также обладают аллотропным свойством – они могут существовать в различных структурных формах. В зависимости от способа упаковки атомов в кристаллической решетке, углерод образует аллотропные модификации, такие как алмаз, графит и фуллерены.
Другое важное свойство углеродов – их способность образовывать пищеваримые соединения. Организмы могут расщеплять углеродные соединения, извлекать из них энергию и использовать ее для своих жизненных процессов.
Таким образом, основные свойства углеродов включают их способность образовывать длинные цепочки, ковалентные связи, способность катенации, аллотропность и пищеваримость.
Подраздел 1.1.2: Важность углеродов в природе
Во-первых, углерод является основным строительным блоком органических соединений. Он образует основу для образования молекул белков, липидов, углеводов и нуклеиновых кислот. Благодаря углероду возможно образование огромного разнообразия органических соединений, что позволяет живым организмам выполнять широкий спектр функций.
Во-вторых, углерод играет ключевую роль в углеродном цикле Земли. Он входит в состав атмосферного углекислого газа и является одним из основных резервуаров углерода. Углерод перераспределяется между атмосферой, гидросферой, литосферой и биосферой, образуя сложные экосистемы и поддерживая баланс углерода в окружающей среде.
В-третьих, углерод является источником энергии для многих организмов. При окислении органических соединений, содержащих углерод, выделяется энергия, необходимая для поддержания жизнедеятельности. Таким образом, углерод играет важную роль в метаболизме и обеспечении энергетических потребностей организмов.
Кроме того, углерод присутствует в природе не только в органическом, но и в неорганическом виде. Например, углерод входит в состав минералов и пород, таких как алмазы и графит. Он также используется в различных технологических процессах и отраслях промышленности, таких как производство пластика, углеродных волокон и топлива.
Видео:Химические свойства элементов 14 (IVA) группы и их соединений. 1 часть. 11 класс.Скачать

Подраздел 1.2: Типы углеродных соединений
Углеводороды:
Углеводороды — это класс соединений, состоящих из атомов углерода и водорода. Они являются основными органическими соединениями и могут быть разделены на несколько типов в зависимости от количества связанных атомов углерода.
Алканы:
Алканы представляют собой насыщенные углеводороды, в которых все атомы углерода связаны с атомами водорода одинарными связями. Они обладают общей формулой CnH2n+2 и называются простыми углеводородами.
Алкены:
Алкены — это ненасыщенные углеводороды, имеющие хотя бы одну двойную связь между атомами углерода. Они обладают общей формулой CnH2n и называются несобственными углеводородами.
Алкины:
Алкины — это такие углеводороды, в которых хотя бы одна тройная связь соединяет атомы углерода. Они обладают общей формулой CnH2n-2 и называются насчитываются несобственными углеводородами.
Гомологические ряды:
Углеводороды различных типов могут быть объединены в гомологические ряды, где каждый последующий член ряда отличается от предыдущего на одну метильную группу (CH2). Это позволяет установить закономерности в физических и химических свойствах углеводородов.
Циклические соединения:
Кроме прямолинейных цепей, углеродные соединения также могут иметь циклическую структуру. Циклические соединения могут быть алициклическими (кольцо содержит только углерод) или ароматическими (кольцо содержит одну или несколько двойных связей).
Алициклические соединения:
Алициклические соединения представляют собой углеродные соединения с одним или несколькими кольцами. Они могут быть насыщенными (циклопропан, циклобутан), ненасыщенными (циклопентен, циклогексен) или ароматическими (бензол).
Ароматические соединения:
Ароматические соединения представляют собой циклические углеводороды, содержащие ароматическое кольцо. Они обладают устойчивой структурой и характерными химическими свойствами. Примеры ароматических соединений включают бензол, толуол, нафталин и др.
Подраздел 1.2.1: Атомарные углеродные соединения
Одним из наиболее известных атомарных углеродных соединений является графит, который представляет собой слоистую структуру углерода. Графит используется в качестве писчего материала и в производстве легких конструкций.
Другим примером атомарного углеродного соединения является алмаз, который представляет собой кристаллическую структуру углерода. Алмаз обладает высокой твердостью и используется в производстве ювелирных изделий и фрезерных инструментов.
Атомарные углеродные соединения могут быть также представлены в виде наночастиц, таких как фуллерены и углеродные нанотрубки. Фуллерены представляют собой сферическую структуру углерода, а углеродные нанотрубки — цилиндрическую структуру. Эти материалы имеют уникальные свойства и находят применение в различных областях науки и техники.
Подраздел 1.2.2: Молекулярные углеродные соединения
Молекулярные углеродные соединения могут быть разделены на несколько классов в зависимости от типа связей и атомных групп, присутствующих в молекуле. Одним из основных классов молекул являются алканы – насыщенные углеводороды, в которых углероды связаны только одинарными связями.
Другим классом молекулярных углеродных соединений являются алкены – углеводороды, содержащие двойную связь между атомами углерода. Алкены обладают большей реакционной способностью по сравнению с алканами.
Еще одним классом молекулярных углеродных соединений являются алкины – углеводороды с тройной связью между углеродными атомами. Алкины являются наиболее реактивными из классов углеводородов и обладают высокой энергией связи.
Важными группами молекулярных углеродных соединений являются также ароматические соединения – циклические углеводороды, содержащие ароматическое ядро. Ароматические соединения обладают специфическим запахом и широко используются в медицине, парфюмерии, пищевой промышленности и других областях.
Молекулярные углеродные соединения играют важную роль в жизни организмов. Они являются основными компонентами биоорганических молекул, таких как углеводы, липиды, нуклеиновые кислоты и аминокислоты. Благодаря своим свойствам и разнообразию структур, молекулярные углеродные соединения способны образовывать огромное количество различных соединений и образований, что делает их важными объектами исследований в химии и биологии.
Видео:Соединения углерода. Видеоурок 34. Химия 9 классСкачать

Раздел 2: Способы классификации углеродов
Углероды, химические элементы, обладают различными свойствами и могут подразделяться на различные группы в зависимости от их структуры и химической природы. Существуют несколько способов классификации углеродов, которые позволяют систематизировать их разнообразие.
Первый способ классификации основан на количестве атомов углерода в молекуле. В зависимости от этого, углероды делятся на моносахариды (содержат один атом углерода), дисахариды (содержат два атома углерода), трисахариды (содержат три атома углерода) и так далее. Эта классификация позволяет группировать углероды по их структуре и реакционной способности.
Второй способ классификации основан на наличии функциональных групп в молекуле углерода. Функциональные группы — это определенные атомы или группы атомов, обладающие определенными свойствами и способностью к химическим реакциям. В зависимости от типа функциональной группы, углероды могут классифицироваться как алканы, алкены, алкины, алкоголи, кетоны, карбоновые кислоты и многие другие.
Третий способ классификации углеродов основан на типе связи между атомами углерода в молекуле. Углероды могут быть классифицированы как насыщенные (все связи между атомами углерода одинарные), ненасыщенные (содержат двойные или тройные связи между атомами углерода) и циклические (атомы углерода образуют замкнутые структуры).
| Способ классификации | Описание |
|---|---|
| По количеству атомов углерода | Моносахариды, дисахариды, трисахариды и т.д. |
| По функциональным группам | Алканы, алкены, алкины, алкоголи, кетоны и др. |
| По типу связи между атомами углерода | Насыщенные, ненасыщенные, циклические |
Эти способы классификации позволяют упорядочить и систематизировать разнообразие углеродов на основе их структуры, свойств и реакционной способности. Это помогает химикам и другим ученым более глубоко изучать углероды и их роли в различных химических процессах и биологических системах.
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Подраздел 2.1: Классификация углеродов по способу связи атомов
Углерод, химический элемент с атомным номером 6, обладает уникальной способностью образовывать большое количество соединений благодаря своей валентности равной четырем. Способ связи атомов углерода может быть различным, что приводит к различным химическим свойствам и формам углерода.
Одной из форм углерода является алмаз, который характеризуется соединением углерода с полным гексагональным кристаллическим строением. Атомы углерода в алмазе образуют твердое трехмерное сетчатое строение, что придает ему высокую твердость и прозрачность.
Другой формой углерода является графит, который отличается от алмаза как строением, так и свойствами. В графите атомы углерода образуют слоистую структуру, где каждый атом углерода связан с тремя другими атомами в плоскость. Это позволяет слоям графита скользить друг относительно друга, что делает графит мягким и смазочным.
Нанотрубки и графен являются еще двумя формами углерода, которые получили особое внимание научного сообщества в последние десятилетия. Нанотрубки представляют собой цилиндрические структуры, образованные свивкой слоев графита, в то время как графен представляет собой однослойный графит, обладающий уникальными электронными свойствами.
Таким образом, углерод может образовывать различные структуры и соединения в зависимости от способа связи атомов. Это делает углерод одним из самых интересных и разнообразных элементов, который находит применение во многих отраслях науки и технологий.
Подраздел 2.1.1: Насыщенные углеродные соединения
Одним из наиболее известных и распространенных классов насыщенных углеродных соединений являются алканы. Алканы представляют собой насыщенные углеводороды, состоящие только из углеродных и водородных атомов. Они имеют общую формулу CnH2n+2, где n — число углеродных атомов. Алканы обладают насыщенной структурой, поскольку все их углеродные атомы связаны только одиночными связями.
Насыщенные углеродные соединения также могут включать другие классы органических соединений, такие как алкены и алкины. Алкены содержат двойные химические связи между углеродными атомами, в то время как алкины содержат тройные связи. Тем не менее, в этом подразделе мы сосредоточимся на насыщенных углеродных соединениях в виде алканов, так как они являются наиболее базовыми и распространенными классами углеродных соединений.
Подраздел 2.1.2: Ненасыщенные углеродные соединения
Примеры ненасыщенных углеродных соединений включают алкены, алкины и ароматические соединения. Алкены содержат одну или несколько двойных связей между углеродными атомами. Алкины, в свою очередь, имеют одну или несколько тройных связей. Ароматические соединения образуются из ароматических углеводородов, таких как бензол, который имеет стабильное кольцевое строение.
Ненасыщенные углеродные соединения обладают рядом уникальных свойств, которые позволяют им применяться в различных сферах. Они могут быть использованы как промежуточные вещества при синтезе органических соединений. Кроме того, они обладают большей реакционной активностью, по сравнению с насыщенными соединениями, и могут быть использованы в химической промышленности для получения различных продуктов.
Ненасыщенные углеродные соединения также имеют важное значение в биологии. Они часто встречаются в биологически активных молекулах, таких как гормоны и ферменты. Например, многие гормоны являются стероидами, которые имеют структуру с несколькими двойными связями. Кроме того, они также могут быть использованы в фармацевтической промышленности для создания лекарственных препаратов.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Подраздел 2.2: Классификация углеродов по структуре
Углероды могут быть классифицированы по структуре, которая определяется их атомным составом и способом соединения атомов углерода.
Существуют следующие основные типы углеродов по структуре:
- Простые углероды. Они состоят из атомов углерода, связанных только одной ковалентной связью. Примером простого углерода является алмаз.
- Сложные углероды. Они состоят из атомов углерода, связанных несколькими ковалентными связями. К сложным углеродам относятся графит и углеродные нанотрубки.
- Циклические углероды. Они состоят из атомов углерода, образующих замкнутые циклы. Примером циклического углерода является бензол, содержащий шесть атомов углерода, расположенных в шестиугольном кольце.
- Алифатические углероды. Они состоят из прямолинейных или разветвленных цепочек атомов углерода. Примерами алифатических углеродов являются пропан, бутан, пентан и другие углеводороды.
- Ароматические углероды. Они состоят из атомов углерода, образующих замкнутую ароматическую систему с кольцевыми пи-связями. Примером ароматического углерода является нафталин.
Классификация углеродов по структуре позволяет лучше понять их свойства и использование в различных областях науки и техники.
Подраздел 2.2.1: Ациклические углеродные соединения
Ациклические углеродные соединения (или алифатические соединения) представляют собой соединения, в которых атомы углерода образуют прямую или разветвленную цепь, не замкнутую в кольцо. Такие соединения могут быть одно- или многоразовыми, то есть содержать одну или несколько углеродных цепей.
Ациклические углеродные соединения обладают различными свойствами и играют важную роль в органической химии. Они могут быть насыщенными или ненасыщенными, то есть содержать только одинарные связи или также двойные или тройные связи между атомами углерода.
Примерами ациклических углеродных соединений являются алканы (основные представители — метан, этан, пропан и др.), алкены (например, этилен, пропилен) и алкины (например, ацетилен). Также среди ациклических соединений можно выделить спирты, эфиры, амины и другие классы органических соединений.
Таблица 2. Ациклические углеродные соединения
| Класс соединений | Примеры | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Алканы | Метан, этПодраздел 2.2.2: Циклические углеродные соединенияЦиклические углеродные соединения (циклогидроуглероды) представляют собой углеродные соединения, образованные замкнутой цепью атомов углерода. Циклические соединения могут быть алициклическими, когда они не содержат двойных или тройных связей, или ароматическими, когда они содержат ароматические системы с конъюгированными пи-связями. Алициклические соединения могут быть разделены на несколько классов в зависимости от количества атомов углерода в кольце. Например, самым простым алициклическим соединением является циклопропан, состоящий из трех атомов углерода, связанных между собой. Другим примером является циклобутан с четырьмя атомами углерода. Более сложные алициклические соединения включают циклогексан, семиуглеродные циклогидроуглероды и так далее. Ароматические соединения, или ароматики, являются особым классом циклических углеродных соединений. Они имеют ароматную природу благодаря конъюгированным пи-системам, состоящим из плоских кольцевых структур с чередующимися двойными и одинарными связями. Наиболее известным примером ароматического соединения является бензол, состоящий из шести атомов углерода в плоском шестиугольном кольце. Другими примерами ароматических соединений являются нафталин, пирен, антрацен и др.
Циклические углеродные соединения имеют широкий спектр свойств и применений. Они могут быть использованы в фармацевтической, пищевой, пластической и других отраслях промышленности. Некоторые циклические соединения также обладают интересными физическими и химическими свойствами, которые делают их полезными для научных исследований. Видео:Химия 9 класс (Урок№18 - Угарный газ. Углекислый газ.)Скачать  Раздел 3: Основные свойства углеродов
Видео:Классификация органических соединений | Химия ЕГЭ 10 класс | УмскулСкачать  Подраздел 3.1: Химические свойства углеродовОдним из главных химических свойств углерода является его способность образовывать прочные и стабильные связи с другими атомами углерода. Это свойство позволяет образовывать разнообразные структуры, включая алканы, алкены, алкины и циклические соединения. Углерод также способен образовывать двойные и тройные связи, что делает его не только основным строительным блоком органических соединений, но и инструментом для синтеза комплексных молекул. Кроме того, углерод обладает уникальным свойством образовывать большие молекулярные структуры, такие как полимеры. Например, полиэтилен и полиэтилентерефталат являются примерами полимеров на основе углерода. Таким образом, химические свойства углеродов обеспечивают его универсальность и широкое применение в различных областях науки и промышленности. Подраздел 3.1.1: Способность к образованию связейСпособность к образованию связей углерода связана с его электронной конфигурацией. Углерод имеет 4 электрона во внешней энергетической оболочке, что позволяет ему образовывать 4 ковалентные связи с другими атомами, включая другие атомы углерода. Каждая ковалентная связь образуется путем совместного использования пары электронов, образующихся из внешней оболочки углерода и атомов, связываемых с ним. Такая способность к образованию связей позволяет углероду образовывать различные формы связей, такие как одинарные, двойные и тройные связи. Кроме того, углерод способен образовывать инжеерные связи, такие как ароматические и конденсированные системы, что делает его ключевым компонентом в органической химии. Подраздел 3.1.2: Влияние окружающей среды на реактивностьОкружающая среда, в которой находятся углеродные соединения, играет существенную роль в их реактивности. Физические и химические свойства углеродных соединений могут зависеть от различных факторов окружающей среды. Температура: Высокая или низкая температура может влиять на скорость реакции углеродных соединений. Например, при повышенной температуре многие органические соединения становятся более реакционноспособными и могут подвергаться интенсивным химическим превращениям. Давление: Высокое давление может способствовать проведению некоторых реакций с углеродными соединениями. Например, в условиях высокого давления многоатомные молекулы могут подвергаться деформации, что может привести к изменению связей и структуры. Окислительное или восстановительное окружение: При наличии окислителей углеродные соединения могут подвергаться окислительным реакциям, а при наличии восстановителей — восстановительным. Таким образом, окружающая среда может определять характер реакции углеродных соединений. Уровень воды: Некоторые углеродные соединения могут образовывать гемиуровни воды и подвергаться влиянию ее электроноакцепторных свойств. Это может способствовать проведению реакций, в которых вода выступает как противоиниция или электронный донор. Полнота денебелизации: При наличии насыщенных углеродных связей реактивность ненасыщенных углеродных соединений может быть значительно изменена. Насыщенные связи обладают меньшей реакционной активностью по сравнению с ненасыщенными связями. Таким образом, окружающая среда может оказывать существенное влияние на реактивность углеродных соединений, определяя их физико-химические свойства и способность к химическим превращениям. Видео:Углерод: химические свойства, аллотропия #углерод #химшкола #неметаллы #егэхимияСкачать  Подраздел 3.2: Физические свойства углеродовТакже углероды могут быть твёрдыми, жидкими и газообразными в зависимости от условий окружающей среды и их структуры. Например, алмаз — твёрдый материал, обладающий высокой твердостью и прочностью. Графит, наоборот, является мягким и смазочным материалом. Еще одним физическим свойством углеродов является их способность проводить электричество. Графит, благодаря своей структуре, обладает высокой электропроводностью, и поэтому широко применяется в электротехнике и промышленности. Кроме того, углероды способны образовывать различные аллотропные модификации, такие как алмаз, графит, углеродные нанотрубки и графен. Каждая из этих модификаций обладает своими уникальными свойствами и находит применение в разных областях науки и техники. Таким образом, физические свойства углеродов являются важными для понимания и использования этих веществ в различных сферах деятельности человека. Подраздел 3.2.1: Температурные свойства углеродовУглерод, как химический элемент, обладает рядом уникальных свойств, включая температурные свойства. При нормальных условиях углерод находится в твердом состоянии и образует кристаллическую решетку. Однако при различных условиях температуры и давления углерод может претерпевать фазовые переходы, что влияет на его структуру и свойства. Наиболее известные аллотропические формы углерода — аморфный углерод, графит и алмаз. Графит представляет собой слоистую структуру, где атомы углерода соединены в плоскостях. Благодаря этой структуре графит обладает свойством смазки и хорошей электропроводимостью. Алмаз же образует твёрдый кристалл, характеризующийся высокой твердостью и прочностью. Он является одним из самых твёрдых материалов на Земле. При достаточно высокой температуре, алмаз начинает превращаться в графит. Температурные свойства углеродов являются важными факторами при применении углеродных материалов в различных областях, таких как промышленность, электроника и наука. Подраздел 3.2.2: Электрофизические свойства углеродовУглеродные материалы, такие как алмазы и графит, обладают проводящими свойствами. Алмазы являются одними из лучших изоляторов, в то время как графит обладает высокой электропроводностью. Проводящие свойства углерода связаны с его графитовой структурой, которая представляет собой слоистую структуру гексагональных плоскостей. Эти слои находятся настолько близко друг к другу, что электроны могут свободно двигаться между ними, обеспечивая электропроводность в графите. С другой стороны, непроводящие свойства углерода связаны с его алмазной структурой, где каждый атом углерода связан с четырьмя соседними атомами, образуя тетраэдрическую структуру. Это приводит к тому, что электроны в алмазе практически неподвижны и не могут проводить электрический ток. Электрофизические свойства углеродов могут быть манипулированы различными способами, такими как добавление примесей или изменение температуры. Например, добавление примесей может увеличить электропроводность углеродных материалов, делая их полупроводниками или даже металлами. Электрофизические свойства углеродов имеют широкое применение в различных отраслях, включая электронику, электротехнику, а также в производстве батарей и суперконденсаторов. 🔥 ВидеоУглерод. Видеоурок 33. Химия 9 классСкачать  Углерод - Самый СТРАННЫЙ химический Элемент!Скачать  КАЖДЫЙ ШКОЛЬНИК поймет химию — Типы ИзомерииСкачать  Органическая Химия — ЭТО НУЖНО ВИДЕТЬ! Гибридизация орбиталейСкачать  ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать  ВСЕ КЛАССЫ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙСкачать  Классификация органических соединений. 9 класс.Скачать 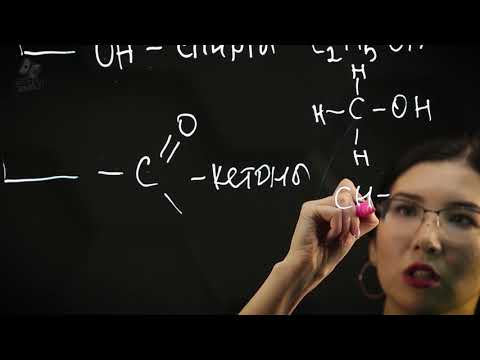 Химия с нуля — АЛКИНЫ, Тройная связь, Типы Гибридизации // Органическая ХимияСкачать  Химия 9 класс : УглеродСкачать  Углерод и кремний IVА группа | Химия ЕГЭ, ЦТСкачать  7.1. Спирты: Номенклатура, классификация, изомерия. ЕГЭ по химииСкачать  9 класс § 34 "Кислородсодержащие соединения углерода"Скачать  |