Неорганические вещества – это химические вещества, которые не содержат углеродных связей или содержат такие связи, но не соблюдают основные правила органической химии. Такие вещества широко используются в различных отраслях промышленности и науке. Все вещества могут быть разделены на группы в соответствии с их физическими и химическими свойствами.
Классификация неорганических веществ основана на особенностях их состава и структуры. Для более удобного и систематического изучения всех неорганических веществ была создана таблица классификации. Эта таблица позволяет легко найти необходимое вещество и получить о нем подробную информацию.
Ко всем неорганическим веществам относятся разные классы и группы веществ. Возможна классификация по области применения веществ, их структуре, свойствам, фазовому состоянию и другим параметрам. Наиболее распространенной классификацией является классификация неорганических веществ по химическому составу и структуре.
- Список неорганических веществ
- Кислоты
- Основания
- Оксиды
- Классификация неорганических веществ
- По катионам
- По анионам
- По типу связей
- Описание неорганических веществ
- Кислоты
- Минеральные кислоты
- Органические кислоты
- Основания
- Гидроксиды щелочных металлов
- Органические основания
- Оксиды
- Металлические оксиды
- Неметаллические оксиды
- 📸 Видео
Видео:Классификация неорганических веществ для ОГЭСкачать

Список неорганических веществ
В таблице представлены основные классы неорганических веществ:
| Класс неорганических веществ | Примеры веществ |
|---|---|
| Кислоты | Соляная кислота, серная кислота |
| Основания | Гидроксид натрия, гидроксид калия |
| Соли | Хлорид натрия, сульфат магния |
| Оксиды | Оксид железа, оксид алюминия |
| Галогениды | Хлорид кальция, фторид натрия |
| Комплексные соединения | Хлорид платины, сульфат железа |
| Вода | Дистиллированная вода, морская вода |
| Газы | Азот, кислород |
Это лишь небольшая часть неорганических веществ, встречающихся в природе или созданных в химической промышленности. Каждый класс неорганических веществ имеет свои особенности и свойства, которые определяют их поведение в различных условиях.
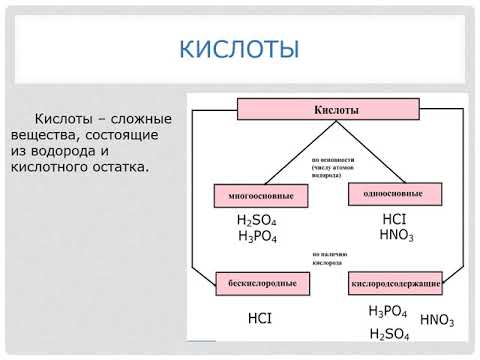
Кислоты
Кислоты образуются при соединении водорода с отрицательно заряженными атомами или группами атомов. Они обычно растворяются в воде, образуя растворы с кислотными свойствами.
Среди кислот выделяются различные типы, включающие минеральные, органические и неорганические кислоты.
Минеральные кислоты – это кислоты, образовавшиеся в результате растворения минералов в воде. Примерами минеральных кислот являются серная кислота (H2SO4), соляная кислота (HCl) и азотная кислота (HNO3).
Органические кислоты – это кислоты, содержащие одну или несколько карбоксильных групп (-COOH). Они часто встречаются в природных продуктах, таких как фрукты, овощи и молочные продукты. Примерами органических кислот являются яблочная кислота (C4H6O5), лимонная кислота (C6H8O7) и молочная кислота (C3H6O3).
Неорганические кислоты – это кислоты, не содержащие углерода. Они включают в себя кислоты, образованные при реакции неорганических соединений с водой. Примеры неорганических кислот включают пермангановую кислоту (HMnO4), фосфорную кислоту (H3PO4) и хлористоводородную кислоту (HCl).
Основания
Основания представляют собой важные соединения, которые широко используются в различных сферах. Они используются в процессе производства химических реактивов, лекарственных препаратов, а также в качестве катализаторов. Основания также применяются в качестве добавок в пищу, антисептиков и многих других продуктах.
В таблице приведены основные основания и их химические формулы:
| Основание | Химическая формула |
|---|---|
| Гидроксид натрия | NaOH |
| Гидроксид калия | KOH |
| Гидроксид кальция | Ca(OH)2 |
| Гидроксид магния | Mg(OH)2 |
| Гидроксид алюминия | Al(OH)3 |
Основания обладают различными свойствами и химическими реакциями. Некоторые из них могут быть очень активными и коррозионно-опасными, поэтому при работе с основаниями необходимо соблюдать соответствующие меры безопасности.
Оксиды
Существует большое разнообразие оксидов, включая оксиды металлов, неметаллов и полуметаллов. Они могут быть кислотными, щелочными или нейтральными в зависимости от химических свойств.
Оксиды металлов обычно образуют ионные соединения и обладают щелочными свойствами. Некоторые из самых распространенных оксидов металлов включают оксид натрия (Na2O) и оксид алюминия (Al2O3).
Оксиды неметаллов, наоборот, могут иметь кислотные свойства. Например, оксид серы (SO2) и оксид азота (NO2) являются кислотными оксидами.
Некоторые оксиды также могут быть нейтральными в зависимости от типа элементов, которые они содержат. Например, оксид углерода (CO2) является нейтральным оксидом.
Оксиды используются в различных отраслях. Например, оксиды металлов используются в производстве стекла, керамики и красок. Оксид азота используется как катализатор в процессе конверсии отработанного топлива.
Оксиды играют важную роль не только в прикладной химии, но и в научных исследованиях. Понимание и изучение свойств и реакций оксидов является фундаментальным для развития различных областей химии.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Классификация неорганических веществ
Неорганические вещества можно классифицировать по различным признакам:
| Классификация | Описание |
|---|---|
| Кислоты | Содержат водород и один или несколько кислородных атомов |
| Основания | Содержат гидроксильные группы |
| Соли | Образуются при реакции кислоты с основанием |
| Оксиды | Содержат кислородный атом в своей структуре |
| Гидроксиды | Содержат гидроксильную группу в своей структуре |
| Сплавы | Смеси двух или более металлов |
| Комплексные соединения | Состоят из центрального металла, окруженного лигандами |
Это лишь некоторые основные классификации неорганических веществ. Очень часто вещества могут попадать в несколько классов одновременно в зависимости от их состава и свойств.
По катионам
Натрий (Na+) — катион щелочного металла, образующий стабильные соли в сочетании с анионами. Натрий является металлом с серебристо-белым цветом, хорошо проводит тепло и электричество. В природе натрий обычно встречается в виде минералов, таких как халит (поваренная соль) и натрон (каменная сода).
Хлор (Cl—) — соль натрия, получаемая путем взаимодействия натрия с хлористым водородом (соляная кислота) и содержащая катион натрия и анион хлорида. Хлор является острым, проникающим запахом газом и широко используется в промышленности и в быту.
Калий (K+) — аналогично натрию, калий является щелочным металлом и образует стабильные соли в сочетании с различными анионами. Одним из наиболее известных соединений калия является поваренная соль, состоящая из катиона калия и аниона хлорида.
Аммоний (NH4+) — катион, образующийся при взаимодействии аммиака с протонами или кислородсодержащими кислотами. Соединения аммония широко используются в промышленности, в частности, в качестве удобрений и веществ для очистки воды.
Магний (Mg2+) — двухвалентный катион щелочноземельного металла, образующий соединения со многими анионами. Магний является легким серебристым металлом, используется в различных отраслях промышленности, в том числе, в производстве сплавов, магниевых солей и качественных антицеллюлитных средств.
Алюминий (Al3+) — трехвалентный катион, который образует соединения с различными анионами. Алюминий является легким серебристым металлом с высокой теплопроводностью и прочностью. Известно множество соединений алюминия, которые используются в промышленности, в том числе, в производстве алюминиевых сплавов, керамики и строительных материалов.
Это только некоторые из катионов, которые встречаются в неорганических веществах. Различные катионы обладают различными свойствами и имеют разную химическую активность, что делает их полезными для разных целей.
По анионам
Приведем некоторые примеры анионов:
| Анион | Описание |
|---|---|
| Сульфат (SO42-) | Сульфатный анион состоит из одного атома серы и четырех атомов кислорода. Он присутствует в многих минералах и солях. |
| Карбонат (CO32-) | Карбонатный анион состоит из одного атома углерода и трех атомов кислорода. Он широко распространен в виде карбонатных минералов и солей. |
| Нитрат (NO3—) | Нитратный анион состоит из одного атома азота и трех атомов кислорода. Он часто используется в качестве удобрения. |
| Фосфат (PO43-) | Фосфатный анион состоит из одного атома фосфора и четырех атомов кислорода. Он важен для живых организмов и широко используется в геологии и сельском хозяйстве. |
Это лишь некоторые примеры анионов, которые можно встретить в неорганических веществах. Изучение и классификация анионов являются важным аспектом в химии и науке о материалах.
По типу связей
В неорганической химии вещества могут быть классифицированы по типу связей, которые участвуют в их образовании. Существуют следующие основные типы связей:
- Ионные связи — это связи, образующиеся между ионами положительного и отрицательного заряда. Ионные связи характерны для солей и многих других неорганических соединений.
- Ковалентные связи — это связи, основанные на обмене электронами между атомами. Они образуются между неметаллами и могут быть одно- или многократными.
- Металлические связи — это связи, характерные для металлов. В металлических соединениях электроны между атомами металла свободно «передвигаются», образуя так называемое «электронное облако».
- Комплексные связи — это связи, возникающие между атомами или молекулами одного вещества. В результате образуется комплекс, в котором один или несколько атомов или молекул связаны с центральным атомом или ионом.
- Координационные связи — это связи, образующиеся между двумя атомами, когда один из них предоставляет пару электронов для образования связи. Одним из наиболее распространенных примеров координационных связей является связь между металлами и лигандами в комплексных соединениях.
Каждый тип связей обладает своими характерными свойствами и играет важную роль в формировании структуры и свойств неорганических веществ.
Видео:Классификация неорганических веществСкачать

Описание неорганических веществ
Неорганические вещества включают в себя соли, оксиды, кислоты, основания и многое другое. Они широко используются в различных отраслях промышленности, медицине, сельском хозяйстве и других областях.
Соли — это соединения, образованные в результате реакции между кислотами и основаниями. Они имеют кристаллическую структуру и обычно растворяются в воде, образуя электролитические растворы.
Оксиды — это неорганические соединения, состоящие из атомов кислорода и других элементов. Они могут быть кислородсодержащими или некислородсодержащими. Кислородсодержащие оксиды взаимодействуют с водой, образуя соответствующие кислоты.
Кислоты — это вещества, которые образуются в результате реакции между кислородсодержащими оксидами и водой. Они могут быть органическими или неорганическими и обладать кислотными свойствами.
Основания — это химические соединения, образованные в результате реакции между кислотами и основаниями. Они обычно обладают щелочными свойствами и могут реагировать с кислотами, образуя соли и воду.
Знание классификации неорганических веществ является важным для понимания их свойств и применения в различных сферах деятельности человека.
Кислоты
Кислоты могут быть органическими и неорганическими. Органические кислоты содержат углерод, в то время как неорганические кислоты не содержат углерод.
Неорганические кислоты образуются при соединении водорода с отрицательно заряженными неорганическими ионами. Примерами неорганических кислот являются серная кислота (H2SO4), соляная кислота (HCl) и азотная кислота (HNO3).
Кислоты могут использоваться в различных областях. Например, серная кислота используется в производстве удобрений и косметических средств, соляная кислота – в обработке металлов и производстве пластмасс, а азотная кислота – в производстве взрывчатых веществ.
Кислоты играют важную роль в химии и промышленности, и их свойства использовались людьми на протяжении многих веков. Изучение кислот и их взаимодействия является основой для понимания многих химических процессов и явлений, а также может быть полезно для развития новых материалов и технологий.
Минеральные кислоты
Минеральные кислоты играют важную роль в различных сферах науки и промышленности. Например, некоторые из них используются в производстве удобрений для земледелия, а другие применяются в химической промышленности для производства различных продуктов.
Среди наиболее известных минеральных кислот можно выделить следующие:
- Соляная кислота (HCl) — одна из самых распространенных и широко используемых кислот. Она образуется в результате растворения хлоридов металлов, таких как натрий или калий.
- Азотная кислота (HNO3) — еще одна важная кислота, которая играет роль в производстве удобрений и взрывчатых веществ. Она образуется при окислении аммиака.
- Сера кислота (H2SO4) — кислота, широко используемая в промышленности, особенно в производстве удобрений и стекла. Она образуется в результате окисления серы.
- Фосфорная кислота (H3PO4) — еще одна важная кислота, которая используется в производстве удобрений и продуктов питания. Она образуется из фосфора.
Это лишь некоторые примеры минеральных кислот. Существует множество других кислот, которые также играют важную роль в химии и промышленности.
Органические кислоты
В природе насчитывается большое количество органических кислот, некоторые из которых имеют важное применение в промышленности и медицине. Например, уксусная кислота (CH3COOH) широко используется в пищевой промышленности и в качестве растворителя, а лимонная кислота (C6H8O7) применяется в производстве пищевых добавок и в косметической индустрии.
Органические кислоты могут быть как насыщенными, так и ненасыщенными. Насыщенные кислоты содержат одиночную связь между углеродными атомами в молекуле, а ненасыщенные кислоты имеют двойные или тройные связи.
Органические кислоты также могут быть классифицированы по их происхождению. Например, жирные кислоты получают из жиров и масел, а аминокислоты являются основными составляющими белковых молекул.
Органические кислоты играют важную роль в биологических процессах, таких как обмен веществ и синтез биологически активных соединений. Они также могут использоваться в качестве катализаторов химических реакций и представлять интерес для различных отраслей промышленности.
Изучение органических кислот является важной частью химического образования и позволяет лучше понять механизмы химических реакций и особенности органического вещества.
Основания
| Свойство | Описание |
|---|---|
| Химическая формула | Основания обычно имеют формулу MO, где M обозначает металл, а O — кислород. Примеры оснований включают гидроксид натрия (NaOH) и гидроксид кальция (Ca(OH)2). |
| Реакция с кислотами | Основания обладают щелочными свойствами и могут реагировать с кислотами, образуя соль и воду. Например, реакция между гидроксидом натрия и соляной кислотой приводит к образованию соли хлорида натрия (NaCl) и воды (H2O). |
| Окислительно-восстановительные свойства | В некоторых случаях основания могут проявлять окислительные или восстановительные свойства. Например, гидроксид калия (KOH) может служить окислителем при реакции с алюминием (Al). |
| Физические свойства | Основания обычно являются твердыми веществами, обладающими высокой плотностью и точкой плавления, хорошей проводимостью электрического тока в расплавленном состоянии. |
Основания используются в различных сферах, включая производство мыла, очистку воды, фармакологию и многие другие промышленные процессы.
Гидроксиды щелочных металлов
Литийгидроксид (LiOH) обладает основными свойствами. Он используется в производстве литий-ионных аккумуляторов, а также в синтезе органических соединений.
Натрийгидроксид (NaOH) известен как пищевая или щелочь. Он широко используется в пищевой промышленности при производстве мыла, моющих средств, промышленных очистителей и других продуктов. Также натрийгидроксид является важным реагентом в лаборатории.
Калийгидроксид (KOH) является калиевой щелочью. Он применяется в производстве мыла, удобрений, стекла, жидкостей для размораживания. Калийгидроксид также используется в лабораторных исследованиях и в процессах синтеза органических соединений.
Рубидийгидроксид (RbOH) и Цезийгидроксид (CsOH) имеют сходные свойства с соответствующими щелочными гидроксидами. Эти соединения также находят применение в различных отраслях химической промышленности и лабораторных исследованиях.
Францийгидроксид (FrOH) — самое тяжелое щелочное гидроксидное соединение, получение которого является сложным заданием из-за крайне высокой реакционной способности франция. Данное соединение имеет ограниченное применение в лабораторных исследованиях.
Органические основания
Основным представителем органических оснований является амин. Амин представляет собой молекулу, в которой атом азота образует три связи с алкильными или арильными группами. В зависимости от количества и типа присоединенных групп, амин может быть первичным, вторичным или третичным. Кроме аминов, к органическим основаниям относятся также аминокислоты, нуклеотиды и другие содержащие атомы азота соединения.
Органические основания могут использоваться в качестве катализаторов, как реагенты в органических реакциях, а также для регулирования рН среды. Некоторые органические основания широко применяются в медицине, например, аминазин и дефероксамин.
Оксиды
Оксиды могут быть разделены на простые и сложные оксиды. Простые оксиды состоят только из атомов одного элемента, например, оксид углерода (CO). Сложные оксиды содержат атомы двух или более элементов, например, оксид железа (Fe2O3).
Оксиды обладают различными физическими и химическими свойствами в зависимости от состава и структуры. Некоторые оксиды являются кислотными и могут образовать кислоты при реакции с водой. Другие оксиды являются основаниями и могут образовывать щелочи при взаимодействии с водой. Также существуют оксиды, которые обладают амфотерными свойствами и могут проявлять и кислотные, и основные свойства.
Оксиды имеют широкий спектр применений. Они используются в производстве стекла, керамики, цемента, а также в качестве катализаторов в химической промышленности. Одним из самых известных оксидов является оксид окиси углерода (CO2), который является главным газовым компонентом атмосферы Земли и играет важную роль в глобальном изменении климата.
Металлические оксиды
Металлические оксиды могут иметь разные степени окисления и формулы, в зависимости от металла, с которым они сочетаются. Некоторые из наиболее известных металлических оксидов включают оксид железа (Fe2O3), оксид алюминия (Al2O3), оксид меди (CuO) и оксид цинка (ZnO).
Металлические оксиды обладают различными физическими и химическими свойствами. Некоторые из них являются твердыми веществами с высокой температурой плавления и кипения, в то время как другие являются газами. Они могут быть магнитными или немагнитными, проводниками или непроводниками электричества.
Металлические оксиды имеют различные применения. Например, оксид железа используется для производства стали, оксид алюминия используется в производстве керамических изделий и алюминиевых сплавов, оксид меди используется в электронике, а оксид цинка используется в производстве резин и пластмасс.
Металлические оксиды также играют важную роль в химических реакциях, таких как окисление-восстановление и катализ. Они могут быть использованы в качестве катализаторов для ускорения химических реакций и в процессах очистки воды и воздуха.
Неметаллические оксиды
Неметаллические оксиды широко используются в различных сферах. Например, диоксид кремния (SiO2) является основным компонентом песка и стекла. Оксид углерода II (CO2) играет важную роль в процессе фотосинтеза и является одним из главных газов, влияющих на парниковый эффект. Серный оксид (SO2) образуется при сгорании сульфидов и используется в производстве серной кислоты и других химических соединений.
Ниже приведена таблица с некоторыми неметаллическими оксидами и их описанием:
| Неметаллический оксид | Описание |
|---|---|
| Диоксид углерода (CO2) | Бесцветный газ без запаха. Является одним из главных компонентов атмосферы Земли. В основном образуется при сгорании органических веществ. |
| Диоксид азота (NO2) | Красно-коричневый газ с резким запахом, ядовит. Образуется при воздействии высокой температуры на азотные оксиды. |
| Диоксид серы (SO2) | Бесцветный газ с характерным запахом. Образуется при сгорании сульфидов. Является одной из причин кислотного дождя. |
| Диоксид азота (NO) | Красновато-желтый газ с резким запахом, ядовит. Образуется при воздействии высокой температуры на азотные оксиды. |
📸 Видео
Тема №4: Классификация неорганических веществСкачать

39. Классы неорганических соединенийСкачать

Все классы в неорганике за 6 часов | Химия ЕГЭ 2023 | УмскулСкачать

Самая ПОДРОБНАЯ классификация неорганических веществ для ЕГЭ по химииСкачать

Классификация неорганических веществСкачать

Химия, 8-й класс, Классификация неорганических веществ по составу и растворимостиСкачать

ВСЯ неорганическая классификация за 45 минут! | Химия ОГЭ 2023 | УмскулСкачать

СУПЕР СПОСОБ — Как определить классы неорганических соединений? #shorts #youtubeshortsСкачать

ЕГЭ ХИМИЯ | Классификация неорганических веществСкачать

3. Основные классы неорганических веществСкачать
ВСЯ ХИМИЯ С НУЛЯ! | Денис Марков | УмскулСкачать

КИСЛОТЫ ХИМИЯ // Урок Химии 8 класс: Кислоты, Кислотный Остаток, Классы Неорганических СоединенийСкачать

8 класс. Классификация неорганических веществ.Скачать

Классификация веществ с нуля | Урок 7 | Полный курс ЕГЭ по химииСкачать

Классификация неорганических веществСкачать

Классификация и номенклатура неорганических веществ: теория + практикаСкачать

КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ | ЕГЭ Химия | Лия МенделееваСкачать
