Амины – это органические соединения, в молекулах которых один или несколько атомов водорода замещены амино-группой (-NH2). В зависимости от числа и типа замещенных атомов водорода, амины могут быть классифицированы на разные типы.
Одноатомные амины представляют собой ароматические или алифатические соединения, содержащие одну амино-группу. Они обладают рядом уникальных свойств, таких как способность к образованию солей, возможность проявлять алкалинные свойства и участвовать в реакциях с кислотами.
Двухатомные амины состоят из двух амино-групп, присоединенных к одному углеродному атому. Эти амины могут быть разделены на простые и сложные двухатомные амины. Простые двухатомные амины содержат оба атома амино-группы в углеродной цепи, тогда как сложные двухатомные амины имеют одну амино-группу в углеродной цепи и другую, присоединенную к атому азота.
Трехатомные амины, также известные как тертиарные амины, состоят из трех амино-групп. Они широко используются в органическом синтезе и являются важными компонентами многих биологически активных веществ. Трехатомные амины обладают различными физическими и химическими свойствами, в зависимости от типа замещенных атомов.
Классификация аминов на основе их структурных свойств позволяет более глубоко изучить их химическую реакционную способность и понять их роль в природных и технических процессах. Знание классификации аминов помогает химикам и биологам разрабатывать новые методы синтеза и использования этих соединений в самых различных областях науки и технологий.
Видео:Классификация и номенклатура аминов. 1 часть. 11 класс.Скачать
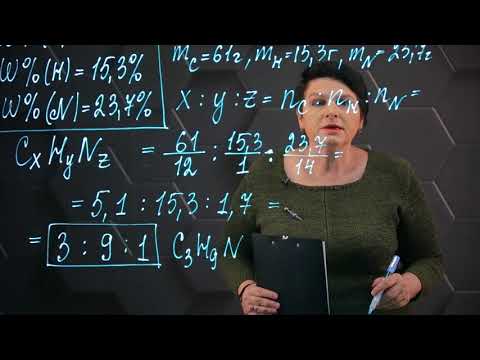
Амины: классификация, типы и свойства
Амины могут быть классифицированы по разным критериям. По числу аминогрупп амины делятся на примарные, вторичные и терциарные. Примарные амины имеют одну аминогруппу, вторичные — две, а терциарные — три. Также амины могут быть алифатическими или ароматическими.
Амины могут образовывать соли, называемые аммониями. Эти соли обладают важными физическими и химическими свойствами. Амины обладают отличными свойствами растворения в воде и удачными реакциями обмена протонов.
Примарные амины могут проявлять базовые свойства и образовывать соли. Вторичные и терциарные амины обычно слабее базовые по сравнению с примарными амины и образуют меньше солей. Однако они могут проявлять нуклеофильные свойства и быть использованы в различных химических реакциях.
Амины имеют разнообразные применения в медицине, фармацевтике, пищевой промышленности и других отраслях. Они используются в качестве медикаментов, консервантов, ароматизаторов и многих других.
Видео:12.1. Амины: Строение, номенклатура, изомерия. ЕГЭ по химииСкачать

Основные типы аминов
1. Первичные амины: в таких соединениях атом азота связан с одной органической или ароматической группой.
2. Вторичные амины: в таких соединениях атом азота связан с двумя органическими или ароматическими группами.
3. Третичные амины: в таких соединениях атом азота связан с тремя органическими или ароматическими группами.
4. Аминокислоты: это амины, содержащие карбоксильную группу (-COOH), которая делает их амфотерными.
5. Ароматические аминов: это амины, в которых атом азота связан с ароматическим кольцом.
Каждый тип амина имеет свои характерные свойства и может использоваться в различных областях, включая фармацевтическую, пищевую и косметическую промышленность. Понимание различий между разными типами аминов позволяет ученым разрабатывать новые соединения с уникальными свойствами и широким спектром применения.
Примарные амины
Примарные амины могут быть разделены на алифатические и ароматические. Алифатические примарные амины имеют прямую цепь углеродных атомов, в то время как ароматические имеют ароматическое кольцо, как, например, анилин.
Важно отметить, что примарные амины обладают щелочными свойствами, так как атом азота имеет свободную пару электронов, которая способна принять протон. При реакции примарных аминов с кислотами образуются соли амина, такие как гидрохлорид или гидробромид.
Примарные амины также являются важными промежуточными продуктами в органическом синтезе. Они могут быть использованы для синтеза азотистых гетероциклических соединений, лекарственных препаратов, красителей и многого другого.
Некоторые из наиболее известных примарных аминов включают метиламин, этаноламин и анилин. Метиламин используется в производстве взрывчатых веществ, этаноламин используется в производстве моющих средств, а анилин используется в производстве красителей и фармацевтических продуктов.
Секундарные амины
Секундарные амины обладают особыми свойствами, которые их отличают от других типов аминов. Во-первых, они могут проявлять как основные, так и кислотные свойства в зависимости от своей структуры. Если радикальная группа (R) обладает электронной плотностью, то амин будет проявлять кислотные свойства, а если радикальная группа (R) обладает отрицательными зарядами, то амин будет проявлять основные свойства. Во-вторых, секундарные амины обладают более высоким кипящим точками и молекулярными массами по сравнению с первичными аминами и амидами.
Примерами наиболее распространенных секундарных аминов являются диэтиламина, N-метилэтаноламина, диметиламиноэтанол и другие. Эти соединения широко используются в органическом синтезе, фармацевтической и пищевой промышленности, а также в качестве растворителей и промежуточных продуктов в различных процессах.
| Примеры секундарных аминов | Структурная формула | Использование |
|---|---|---|
| Диэтиламина | Органический синтез, лабораторные исследования | |
| N-метилэтаноламина | Фармацевтическая и пищевая промышленность | |
| Диметиламиноэтанол | Растворители, промежуточные продукты |
Терциарные амины
Они обладают следующими свойствами:
1. Алкилирование азота:
Из-за наличия свободного электронного парамагнитного азота, терциарные амины могут быть алкилированы с помощью соответствующих алкилгалогенов, образуя кватернарные аммонийные соли.
2. Ионообменные свойства:
Терциарные амины образуют стабильные соли с кислотами. Однако, поскольку аминная группа терциарных аминов не может образовывать ионы, они не могут действовать как основания в слабых кислотах.
3. Некоторые терциарные амины обладают холиномиметической активностью:
Некоторые терциарные амины, такие как галантамин, могут работать как ингибиторы ацетилхолинэстеразы, повышая уровень ацетилхолина и улучшая когнитивные функции в некоторых неврологических заболеваниях.
Видео:Получение и свойства аминов. 1 часть. 11 класс.Скачать

Свойства аминов
Вот некоторые основные свойства аминов:
| Свойство | Описание |
|---|---|
| Основность | Аминогруппы способны принимать водородные ионы (H+) и образовывать соли с кислотами. Это свойство делает амины базами, и они могут реагировать с кислотами, демонстрируя нейтрализацию. |
| Амфотерность | Амины могут действовать как кислоты и базы, взаимодействуя как с кислотами, так и с основаниями. |
| Восстановительные свойства | Некоторые амины обладают способностью восстанавливать окислители, проявляя сильные восстановительные свойства. |
| Растворимость | Многие амины хорошо растворяются в воде благодаря возможности образования водородных связей с молекулами воды. Но с ростом размера аминогруппы и их нестеричности растворимость снижается. |
| Аминазная активность | Некоторые амины могут действовать как катализаторы реакций, известные как аминазы. |
| Токсичность | Некоторые амины могут быть токсичными для живых организмов, и их поглощение может вызывать негативные побочные эффекты. |
Это лишь некоторые из свойств аминов, и они могут варьироваться в зависимости от структуры и свойств соединения. Понимание свойств аминов позволяет лучше понять их важную роль в органической химии и биологических процессах.
Амфотерность
Некоторые аминовые соединения проявляют амфотерность благодаря наличию в их молекулах двух или более функциональных групп, способных к ассоциации с протонами в качестве основных или кислотных центров.
Как и в случае с другими амфотерными веществами, аминовая молекула может выступать в качестве кислоты (т.е. давать водородные ионы), когда образует связь с двухатомными базами, такими как гидроксид гидрогена (НО) или литий (Li), или в качестве основания (принимая водородные ионы), когда образует как сильную, так и слабую связь с кислыми группами.
Амфотерность аминов обусловливает широкий класс реакций, в том числе гидролиз, нейтрализацию, конденсацию, растворение солей и органических кислот, взаимодействие с оксидами металлов и т. д.
Базичность
При растворении аминов в воде амино-группа, подавляющее большинство случаев, принимает положительный заряд, что делает молекулы аминов веществами с щелочными свойствами. Базичность аминов позволяет им образовывать соли с кислотами, а также реагировать с кислотными соединениями.
За счет своей бескоалиционности амино-группа аминов может образовывать связь с различными кислотными радикалами. В зависимости от химической природы радикала и его силы, амин может образовывать различные соли и соединения, проявляющие определенные свойства.
Аминовые соли могут быть как твердыми, так и жидкими веществами, в зависимости от свойств аминов и кислотных компонентов. Некоторые аминовые соли имеют особое значение в фармацевтической и медицинской промышленности, где они используются в качестве активных фармацевтических веществ.
Базичность аминов можно классифицировать по их степени:
- Первичные амины, имеющие одну аминогруппу (-NH2)
- Вторичные амины, имеющие две аминогруппы (-NH2)
- Третичные амины, имеющие три аминогруппы (-NH2)
- Алифатические амины, содержащие аминогруппу (-NH2) на алифатическом углероде
- Ароматические амины, содержащие аминогруппу (-NH2) в ароматическом кольце
Знание базичности аминов позволяет понять их взаимодействие с другими химическими соединениями, их возможности в реакциях, а также определить их физические свойства.
Образование солей
Соли образуются при реакции кислоты с основанием. В химическом представлении это реакция нейтрализации. Кислота отдает свой протон (водородный катион) основанию, а основание отдает свою отрицательную частицу (антион) кислоте. В результате такой реакции образуется соль и вода.
Соли могут быть как бесцветными, так и иметь яркий окрас. Они обладают хорошей растворимостью в воде и некоторых других растворителях. Большинство солей образуют кристаллы с характерной регулярной структурой. Они могут быть достаточно твердыми и иметь хрупкость.
Соли используются в различных областях нашей жизни. Например, хлористый натрий (NaCl) применяется для приготовления пищи и в процессе очистки воды. Карбонат кальция (CaCO3) является основным компонентом мрамора и известняка. Многие соли используются в качестве удобрений, медицинских препаратов, покрытий для поверхности и т.д.
Образование солей — важный процесс, обусловленный взаимодействием кислот и оснований. Соли играют важную роль в химической промышленности и в нашей жизни в целом. Изучение свойств и особенностей солей является одной из важных задач химии.
💥 Видео
ВСЯ ТЕОРИЯ ПО АМИНАМ ДЛЯ ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать

ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Амины - органические основания | Химия 10 класс #42 | ИнфоурокСкачать

Химические свойства аминов | Химия ЕГЭ для 10 класса | УмскулСкачать

Химические свойства аминов: понять, а не заучить | Химия ЕГЭ 2022 | УмскулСкачать

ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

55. Амины (часть 1)Скачать

10 класс Физические и химические свойства аминовСкачать

12.3. Амины: Химические свойства. ЕГЭ по химииСкачать

Химические свойства аминов | Химия 10 класс | УмскулСкачать

Классификация и номенклатура аминов. 2 часть. 11 класс.Скачать

Получение и свойства аминов. 2 часть. 11 класс.Скачать

7.1. Спирты: Номенклатура, классификация, изомерия. ЕГЭ по химииСкачать

Типы Химических Связей — Как определять Вид Химической Связи? Химия 9 классСкачать

Химия 10 класс: Химические свойства аминовСкачать

Введение в номенклатуру аминовСкачать

Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать
