Комплексы являются основными объектами изучения в области координационной химии. Они представляют собой соединения, в которых металл образует связь с одним или несколькими лигандами. Важным понятием, связанным с комплексами, является классификация по природе лигандов.
Лиганды — это атомы или группы атомов, которые связываются с металлом через координационную связь. По природе лигандов комплексы могут быть классифицированы на несколько основных типов.
Органолиганды — это лиганды, содержащие органические группы. Они могут быть представлены различными соединениями, такими как алкилы, ароматические соединения или группы с несколькими атомами углерода. Примерами органолигандов являются этилен Диаминтетрагуандин (едтг), контениды и кетоны.
Неорганические лиганды — это лиганды, не содержащие органических групп. Они могут быть атомами из групп таблицы Менделеева, такими как кислород, азот или сера, или иметь особую структуру, например, цианид или гидроксид. Примерами неорганических лигандов являются аммиак, оксиды и галогены.
Замещенные лиганды — это лиганды, которые замещают другие лиганды в комплексе. Это может происходить в результате реакции с другими веществами или под воздействием физических условий. Замещенные лиганды могут иметь разные свойства и могут изменять характер комплекса.
Таким образом, классификация комплексов по природе лигандов позволяет понять основные типы комплексов и их характеристики. Она отражает широкий спектр соединений, которые могут быть образованы в координационной химии, и примеры из каждого типа лигандов помогают лучше понять их различия и свойства.
- Что такое комплексы?
- Определение комплексов
- Роль комплексов в химии
- Общая характеристика комплексов
- Структура комплексов
- Центральный атом
- Лиганды
- Классификация комплексов по природе лигандов
- Органические лиганды
- Примеры органических лигандов
- Основные свойства органических лигандов
- Неорганические лиганды
- Примеры неорганических лигандов
- Основные свойства неорганических лигандов
- Характеристики комплексов в зависимости от типа лигандов
- Физические свойства комплексов
- Цветность комплексов
- Магнитные свойства комплексов
- Химические свойства комплексов
- Стабильность комплексов
- Диссоциация комплексов
- Роль комплексов в различных областях
- Применение комплексов в катализе
- Роль комплексов в биологии
- 📺 Видео
Видео:Комплексные соединения. 1 часть. 11 класс.Скачать

Что такое комплексы?
Комплексы представляют собой особую группу химических соединений, состоящих из центрального металла и одного или нескольких лигандов, которые связаны с металлом через координационные связи.
Лиганды — это атомы, ионы или молекулы, которые могут содержать один или несколько атомов и обладают неспаренными электронными парами, способными формировать соединение с металлом.
Комплексы классифицируются по природе лигандов, их числу и степени окружения металла. Основными типами комплексов являются одноядерные комплексы, состоящие из одного лиганда и одного металла, и полинуклеарные комплексы, которые могут содержать несколько металлов и лигандов.
Свойства и характеристики комплексов определяются как металлом, так и лигандами. Металл может влиять на степень окисления, атомную массу, электронную структуру и проявлять различные химические свойства в комплексах. Лиганды, в свою очередь, могут определять степень устойчивости комплекса, его реакционную активность и соединение с другими соединениями.
Комплексы широко применяются в различных областях химии, биологии и медицины, включая катализ, синтез органических соединений, хранение и транспортировку металлов в организмах и др.
Определение комплексов
Комплексы бывают различных типов в зависимости от природы лигандов и характера образования связи. Основные типы комплексов – органические комплексы, неорганические комплексы и координационные соединения.
Органические комплексы – это комплексы, в которых лигандами являются органические соединения, такие как аминокислоты или витамины. Они обычно образуются в органических растворителях и имеют важное значение в биохимии и фармакологии.
Неорганические комплексы – это комплексы, в которых лигандами являются неорганические соединения, такие как вода или хлориды. Они могут образовываться в поверхностных водах или в результате химических реакций.
Координационные соединения – это комплексы, в которых лигандами могут быть как органические, так и неорганические соединения. Они образуются в результате координационной связи между лигандами и центральным атомом или ионом.
| Тип комплекса | Природа лигандов | Характер образования связи |
|---|---|---|
| Органические комплексы | Органические соединения | Образуются в органических растворителях |
| Неорганические комплексы | Неорганические соединения | Могут образовываться в поверхностных водах или в результате химических реакций |
| Координационные соединения | Органические и неорганические соединения | Образуются в результате координационной связи |
Роль комплексов в химии
Комплексы играют важную роль в современной химии и имеют широкий спектр применений. Они используются для разработки новых лекарственных препаратов, катализаторов, материалов с определенными свойствами, а также в аналитической химии для определения концентрации веществ.
Одним из главных преимуществ комплексов является их стабильность. Благодаря своей структуре и связям, комплексы обладают высокой устойчивостью к внешним воздействиям и могут сохранять свои химические свойства в различных условиях.
Комплексы также имеют способность образовывать особые связи с другими молекулами, что позволяет им выполнять функцию катализаторов. Каталитические комплексы способны ускорять химические реакции, снижая их энергию активации и повышая эффективность процесса.
Кроме того, комплексы обладают уникальными физическими свойствами, такими как светоизлучение, магнитные свойства и возможности для формирования сложных структур. Эти свойства делают комплексы полезными во многих областях, включая электронику, оптику и нанотехнологии.
Таким образом, комплексы являются важными объектами изучения в химии и имеют большой потенциал для развития новых технологий и материалов.
Видео:Строение комплексных соединений с точки зрения теории кристаллического поля.Скачать

Общая характеристика комплексов
Комплексы могут быть одноядерными или многоядерными. В одноядерном комплексе центр координации связан только с одним лигандом, в то время как в многоядерном комплексе центр координации связан с двумя или более лигандами.
Классификация комплексов осуществляется по природе лигандов. Лиганды могут быть ионными или нейтральными, одноатомными или полиатомными, органическими или неорганическими. От природы лигандов зависит степень их поляризации, что влияет на степень поляризации координационной связи, а следовательно, и на физические и химические свойства комплекса.
| Тип комплекса | Характеристики |
|---|---|
| Органометаллические комплексы | Содержат органические лиганды, образующие координационные связи с металлическим центром |
| Комплексы переходных металлов | Содержат переходные металлы в качестве центра координации |
| Комплексы п элементов | Содержат элементы главной подгруппы в качестве центра координации |
| Комплексы ф элементов | Содержат элементы лантаноидов или актиноидов в качестве центра координации |
| Комплексы простых ионов | Содержат простые ионы в качестве лигандов |
Помимо классификации по природе лигандов, комплексы также могут быть классифицированы по степени окружения центра координации. Например, октаэдрические комплексы имеют восемь лигандов, расположенных вокруг центрального иона или атома, а тетраэдрические комплексы имеют четыре лиганда.
Видео:Комплексные соединения. Строение и классификация. Теория А. Вернера.Скачать

Структура комплексов
Центр металла: металлический ион, который является основным компонентом комплекса. Он может быть лигандоориентированным, что означает, что лиганды связаны с металлом напрямую, или неориентированным, когда металл не прямо связан с лигандами, а образует с ними взаимодействие через другие атомы.
Лиганды: молекулы или ионы, которые связываются с центром металла. Лиганды могут быть органическими (например, этилендиамин) или неорганическими (например, хлор). Количество и тип лигандов могут влиять на физические и химические свойства комплексов.
Координационное число: количество лигандов, связанных с центром металла. Координационное число определяет структуру комплекса и может варьироваться от 2 до более чем 8.
Геометрия комплекса: описание архитектуры комплекса, определяемое координационным числом и типом лигандов. Некоторые из распространенных геометрий включают октаэдральную, квадратно-плоскостную и октаэдрально-квадратную.
Комплексы являются важными объектами изучения в координационной химии и имеют широкий спектр применений в различных областях, включая катализ, медицину и материаловедение.
Центральный атом
Центральный атом может быть металлом или неметаллом. В комплексах с металлическим центром, центральный атом представляет собой металл, который образует донорные связи с лигандами при помощи своих d- или f-орбиталей. Такие комплексы называют металлокомплексами.
В комплексах с неметаллическим центром, центральный атом может быть, например, кремнием, фосфором или серой. В этих случаях, центральный атом образует связи с лигандами при помощи своих п- или d-орбиталей.
| Центральный атом | Примеры металлокомплексов | Примеры комплексов с неметаллическим центром |
|---|---|---|
| Металл | Ферроцен, трехядерный комплекс ртути | — |
| Неметалл | — | Фосфанил, сульфанил |
Центральный атом может также образовывать связи с другими центральными атомами, образуя более сложные структуры, такие как полинуклеарные комплексы. В таких комплексах, центральные атомы обладают сравнимой активностью и могут быть металлами или неметаллами.
Центральный атом определяет химическую стойкость и реакционную способность комплекса, а также его спектральные свойства. Поэтому, выбор центрального атома играет важную роль в синтезе и применении комплексов в различных областях химии и технологии.
Лиганды
Одноатомные лиганды – это молекулы, состоящие из одного атома. Примерами таких лигандов могут быть водород (H2), карбонил (CO) или азид (N3—).
Полихалогенные лиганды представляют собой молекулы, состоящие из нескольких атомов одной или разных химических элементов. Примерами таких лигандов могут быть хлорид (Cl—), оксид (O2-) или гидроксид (OH—).
Органические соединения – это лиганды, которые содержат углерод и другие элементы, такие как кислород, азот, сера и фосфор. Примерами органических лигандов могут быть этилендиамин (C2H8N2), ацетат (CH3COO—) или фенантролин (C12H11N).
Лиганды могут образовывать связи с металлическим ионом через атомные или молекулярные орбитали. Тип связи и характер взаимодействия лиганда с ионом могут варьироваться в зависимости от химических свойств лиганда и металла.
Лиганды могут быть небесцветными или иметь яркие цвета. Кроме того, они могут вносить изменения в химическую активность металлического иона. Например, лиганды могут модифицировать окислительно-восстановительные свойства и степень ковалентности связи между лигандом и ионом.
Общая классификация лигандов по природе и типу связи предложена в системе Й. Б. Нейлона и включает в себя ряд основных типов, таких как одноатомные, полихалогенные и органические лиганды. Классификация лигандов позволяет более точно определить и объяснить особенности формирования и свойства комплексов.
Видео:Ерёмин В. В. - Общая химия - Комплексные соединения (Лекция 7)Скачать

Классификация комплексов по природе лигандов
Лиганды в комплексах могут быть разных типов и обладать различными характеристиками. Существует несколько основных типов классификации комплексов по природе лигандов:
- Неорганические лиганды: это неорганические соединения, такие как вода (H2O), хлориды (Cl-), оксиды (O2-), аммиак (NH3), ионы металлов (как Mn2+ или Fe3+), и другие.
- Органические лиганды: это органические соединения, содержащие одну или несколько функциональных групп, которые могут образовывать комплексы с металлами. Примеры включают этилендиамин (EN), октамино (OEN), короны (например, 18-кольцевая корона-6) и другие.
- Биологические лиганды: это лиганды, которые образуют комплексы с белками в организме. Примеры биологических лигандов включают гем (содержащийся в гемоглобине), НАД+ (коэнзим Никотинамидадениннуклеотид), ДНК, РНК и другие.
Каждый тип лиганда обладает своей химической структурой и специфическими свойствами, которые влияют на свойства и реактивность соответствующих комплексов. Понимание классификации комплексов по природе лигандов позволяет лучше понять и изучить химические свойства и применение этих соединений.
Видео:Комплексные соединенияСкачать

Органические лиганды
Органические лиганды играют важную роль в координационной химии, поскольку определяют химические и физические свойства комплексов. Они могут образовывать стабильные комплексы с различными металлами, такими как железо, медь, цинк и др.
Характерной особенностью органических лигандов является наличие функциональных групп, способных образовывать координационные связи с металлами. Эти функциональные группы могут быть аминогруппами, карбоксильными группами, оксогруппами и др.
Органические лиганды могут образовывать монодентатные связи с металлами, когда одна функциональная группа вступает в связь с одним атомом металла, и многодентатные связи, когда несколько функциональных групп вступают в связь с одним или несколькими атомами металла. Многодентатные органические лиганды образуют хелатные комплексы, которые обладают высокой стабильностью.
Органические лиганды могут обладать различными свойствами, такими как кислотность, основность, способность к каталитической активности и др. Они могут использоваться в различных областях, таких как фармацевтическая промышленность, катализ, экология и др.
Использование органических лигандов позволяет получать комплексы с определенными свойствами, контролировать их активность и селективность. Также они являются важными компонентами в биологических системах, участвуя в различных процессах, таких как транспорт и хранение металлов, катализ ферментативных реакций и др.
Примеры органических лигандов
- Этилендиамин (en)
- Этиленгликоль (eg)
- Тиозол
- Пиролл
- Бипиридин
- Тиоцианат
- Ацетилцетонат
- Этиленбис(изоникотинамид)
Каждый из этих лигандов имеет свою уникальную структуру и способность образовывать комплексы с определенными металлами. Органические лиганды играют важную роль в различных областях химии, включая координационную химию, синтез органических соединений и катализ. Они могут быть использованы для создания новых материалов, лекарственных препаратов и катализаторов.
Основные свойства органических лигандов
Основные свойства органических лигандов:
| Свойство | Описание |
|---|---|
| Лигандность | Органические лиганды обладают способностью образовывать координационные связи с металлами за счет наличия акцепторных или донорных атомов или групп. |
| Координационная способность | Органические лиганды имеют различную способность к образованию комплексов, которая зависит от их строения и функциональных групп. |
| Структура и геометрия | Структура органических лигандов может быть линейной, циклической или ветвистой. В зависимости от структуры и числа атомов, они могут изменять геометрическую конфигурацию комплексов. |
| Функциональные группы | В органических лигандах могут присутствовать различные функциональные группы, такие как амины, карбонильные группы, фенилы и др., которые определяют их химические свойства и способность к образованию комплексов. |
| Реакционная способность | Органические лиганды могут участвовать в различных химических реакциях, в том числе взаимодействовать с другими соединениями и металлами, образуя новые соединения и комплексы. |
Все эти свойства органических лигандов играют важную роль в формировании и стабилизации комплексов с металлами и находят широкое применение в различных областях химии и биологии.
Видео:013 Комплексы 4 ВС и ТКПСкачать

Неорганические лиганды
Одним из наиболее распространенных типов неорганических лигандов являются анионы, такие как гидроксиды (OH-), оксиды (O2-), хлориды (Cl-), карбонаты (CO32-) и многие другие. Эти анионы могут образовывать комплексы с металлами, образуя стабильные и химически активные соединения.
Другим типом неорганических лигандов являются нековалентные металлические кластеры. Это комплексы, состоящие из нескольких атомов металла, связанных между собой через атомы других элементов. Нековалентные металлические кластеры обладают уникальными свойствами и могут использоваться в качестве катализаторов, сенсоров и магнитных материалов.
Еще одним классом неорганических лигандов являются нейтральные соединения, такие как вода (H2O), аммиак (NH3) и фосфин (PH3). Эти соединения могут образовывать комплексы с металлами и обладают разнообразными свойствами и возможностями реакции.
Неорганические лиганды имеют важное значение в химии координационных соединений и позволяют создавать разнообразные комплексы с различными свойствами и функциональностями. Изучение этих лигандов является важной задачей в области неорганической химии и может привести к разработке новых материалов и применений.
Примеры неорганических лигандов
В неорганической химии существует множество различных типов неорганических лигандов, которые могут образовывать комплексы с металлами. Некоторые из них включают:
1. Водород (H2) — один из самых распространенных и важных неорганических лигандов. Он может образовывать металловодородные комплексы.
2. Карбонаты (CO32-) — анионы, состоящие из углерода и кислорода, которые могут образовывать комплексы с многими металлами. Примером являются комплексы металлокарбонатов.
3. Аммиак (NH3) — неорганический лиганд, содержащий азот и водород. Он может образовывать комплексы с различными металлами, включая комплексы аминоцинкатов.
4. Фосфаты (PO43-) — анионы, состоящие из фосфора и кислорода, которые могут образовывать комплексы с различными металлами. Примером являются комплексы металлофосфатов.
5. Силикаты (SiO44-) — анионы, состоящие из кремния и кислорода, которые могут образовывать комплексы с металлами. Примером являются комплексы металлосиликатов.
Это лишь некоторые из множества неорганических лигандов, которые могут образовывать комплексы с металлами. Каждый из них обладает своими характеристиками и способностью образовывать стабильные связи с металлом.
Основные свойства неорганических лигандов
Неорганические лиганды играют важную роль в формировании комплексных соединений и определяют их свойства и характеристики. Они обладают рядом уникальных особенностей, которые определяют их поведение и взаимодействие с другими соединениями.
Вот некоторые основные свойства неорганических лигандов:
- Заряд. Неорганические лиганды могут быть одноатомными и многозарядными. Многозарядные лиганды могут образовывать комплексы с металлами разных зарядов, что приводит к разнообразию структур и свойств комплексов.
- Атомный радиус. Размер атома лиганда влияет на его способность образовывать комплексы и взаимодействовать с металлом. Большие лиганды могут обхватывать металл широкими «объятиями», в то время как маленькие лиганды могут образовывать комплексы с более высокими степенями координации.
- Химическая активность. Неорганические лиганды могут быть химически активными и участвовать в различных химических реакциях. Например, некоторые лиганды могут проявлять кислотные или основные свойства и образовывать соли с металлами.
- Лигандная сила. Лигандная сила зависит от различных факторов, включая химическую природу лиганда, его заряд, электроотрицательность и размер. Лиганды сильно координирующие (например, цианид, дитиофосфат) могут образовывать комплексы с высокой устойчивостью.
- Форма. Некоторые неорганические лиганды имеют определенную форму, что позволяет им образовывать комплексы с определенной геометрией. Например, лиганды типа кетонов и аминоацидов могут образовывать октаэдрические комплексы.
Изучение свойств неорганических лигандов позволяет лучше понять их поведение в комплексных соединениях и применить их в различных областях химии, фармакологии и катализе.
Видео:Классификация комплексных соединений. 11 класс.Скачать

Характеристики комплексов в зависимости от типа лигандов
Свойства и характеристики комплексов сильно зависят от типа лигандов, которые образуют комплекс с металлом.
Если в комплексе присутствуют лиганды-доноры, то такие комплексы могут обладать спектроскопическими свойствами, такими как поглощение или испускание света.
Комплексы, в которых присутствуют лиганды-акцепторы, могут образовывать сильные связи с металлом и проявлять каталитическую активность.
Ароматические лиганды, такие как ароматические соединения или ароматические аминокислоты, могут образовывать комплексы с металлом, которые обладают стойкостью и устойчивостью к окружающей среде.
Лиганды-бриджи, которые могут связываться с несколькими металлами одновременно, могут образовывать полимерные комплексы или комплексы с широкими пространственными структурами.
Таким образом, тип лигандов в комплексе существенно влияет на его свойства и характеристики, определяя его реакционную активность и структуру.
Видео:Номенклатура комплексных соединений. 11 класс.Скачать

Физические свойства комплексов
Физические свойства комплексов зависят от множества факторов, включая природу лиганда, степень окисления металла, а также его координационное окружение. Однако, существуют некоторые общие характеристики, которые можно применить для классификации комплексов.
Одним из основных физических свойств комплексов является их цвет. Цвет комплекса определяется электронными переходами в металл-лигандных связях. При наличии электронных переходов, комплекс может поглощать и испускать свет различных цветовых длин волн, что приводит к его окрашиванию. Например, диоксид титана (ТiО2) обладает белым цветом, однако, при добавлении малых количеств железа (Fe), комплекс становится окрашенным в желтый цвет.
Еще одним физическим свойством комплексов является их магнитная восприимчивость. Комплексы могут быть как парамагнитными, так и диамагнитными в зависимости от спиновых свойств лигандов и металла. Парамагнитные комплексы содержат неспаренные электроны, которые создают магнитный момент. Диамагнитные комплексы не содержат неспаренных электронов и не обладают магнитным моментом.
Также стоит упомянуть о растворимости комплексов. Многие комплексы являются растворимыми в воде или органических растворителях, однако, некоторые комплексы могут быть нерастворимыми и образовывать осадки. Растворимость комплексов влияет на их применение в различных областях, таких как катализ, медицина, электрохимия и другие.
И наконец, можно отметить важное физическое свойство комплексов — их термическую стабильность. Некоторые комплексы могут выдерживать высокие температуры, сохраняя свою структуру и свойства. Термическая стабильность комплексов может быть использована, например, при производстве катализаторов для химических процессов.
Цветность комплексов
Цветность комплексов зависит от нескольких факторов, включая вида и свойств лигандов, атомного номера металла, его валентности и структуры комплекса.
В случае комплексов, обладающих яркой цветностью, переход электронов происходит в видимой части спектра электромагнитного излучения. Таким образом, комплексы с различными цветами отличаются от остальных видимыми спектральными поглощениями и отражениями.
Например, комплексы с низкоспиновыми d^1- и d^2-конфигурациями, как правило, имеют цветность, связанную с эффектами обменного взаимодействия между электронами в 3d- и 4s-орбиталях металла.
Кроме того, некоторые лиганды могут обладать орбитальными эффектами, влияющими на цветность комплексов. Например, лиганды со специальной ароматной и конъюгированной структурой могут вызывать цветность, связанную с эффектами конъюгированных электронных переходов.
Таким образом, цветность комплексов является полезным инструментом для их идентификации и классификации на основе природы лигандов и других факторов.
Магнитные свойства комплексов
Магнитные свойства комплексов зависят от ряда факторов, таких как:
- Валентность центрального атома — некоторые металлы, такие как железо, никель или кобальт, могут образовывать комплексы с неспаренными электронами, что придает им магнитные свойства;
- Степень поляризации лиганда — если органический лиганд обладает сильными ароматными системами, он может обеспечить электронный допинг и полная магнетизация становится возможной;
- Геометрическая конфигурация комплекса — необходима определенная симметрия расположения лигандов относительно металлического центра для появления магнитных свойств;
- Наличие магнитных атомов в лидирующих режимах;
- Размер и форма комплекса — большие комплексы обладают более выраженными магнитными свойствами.
Магнитные свойства комплексов имеют важное значение в различных областях, таких как катализ, электроника и нанотехнологии. Изучение и классификация этих свойств позволяют оптимизировать состав и структуру комплексов для достижения конкретных целей и применений.
Видео:Комплексные соединенияСкачать
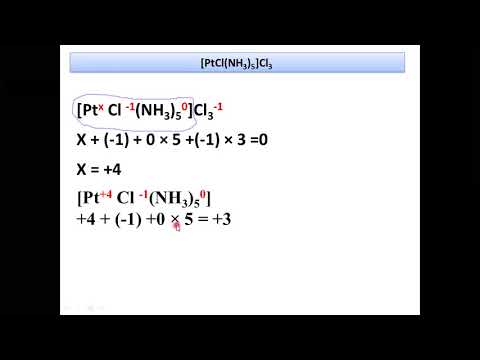
Химические свойства комплексов
Комплексы обладают различными химическими свойствами, которые определяются структурой и характером взаимодействия металла с лигандами.
Одним из основных химических свойств комплексов является ионная обменная способность. Комплексы могут вступать во взаимодействие с другими ионами и молекулами, обмениваясь лигандами и образуя новые соединения. Это свойство является основой для использования комплексов в катализе и синтезе органических соединений.
Другим важным химическим свойством комплексов является их устойчивость. Комплексы могут быть стабильными и устойчивыми в определенных условиях, или же быть лабильными и легко распадаться. Устойчивость комплексов зависит от различных факторов, таких как электрохимический потенциал металла и характер связи металл-лиганд.
Также, комплексы могут проявлять свойства кислот и оснований. Некоторые комплексы могут обладать кислотными свойствами и отдавать протоны, а другие — основными свойствами и принимать протоны. Это свойство комплексов определяется структурой и электронной конфигурацией металла в комплексе.
Таким образом, химические свойства комплексов определяют их реакционную способность и возможность использования в различных химических процессах.
Стабильность комплексов
Одним из важных факторов, влияющих на стабильность комплексов, является кинетическая и термодинамическая стабильность. Кинетическая стабильность определяет скорость образования и распада комплексов, а термодинамическая стабильность – энергию, необходимую для разрушения комплексного соединения.
Природа лигандов также оказывает существенное влияние на стабильность комплексов. Лиганды могут быть классифицированы по их силе связывания с металлом. Некоторые лиганды образуют более стабильные комплексы, так как они обладают большим числом атомов и/или несколькими активными центрами, что позволяет им установить более прочные связи с металлом.
Кроме того, комплексы могут быть стабилизированы внутримолекулярными взаимодействиями, такими как водородные связи и атомные или ионные взаимодействия. Эти взаимодействия могут увеличивать стабильность комплексного соединения и предотвращать его разрушение.
Окружающая среда также может влиять на стабильность комплексов. Наличие растворителя или других химических веществ может изменять свойства комплекса, включая его структуру и стабильность. Например, некоторые растворители могут усиливать или ослаблять взаимодействие лигандов с металлом.
Исследование стабильности комплексов является важной задачей в координационной химии и находит применение в различных областях, включая катализ, биохимию, фармацевтику и материаловедение.
Диссоциация комплексов
Диссоциация может происходить под воздействием различных факторов, таких как изменение концентрации или pH среды, температуры или воздействие других веществ.
В результате диссоциации образуются соли или ионы, а лиганды освобождаются и могут образовать новые комплексы с другими центральными ионами.
Понимание процесса диссоциации комплексов является важным для изучения реакций, протекающих в растворах, а также для понимания химической структуры и свойств комплексных соединений.
Видео:Константа нестойкости и диссоциация комплексных соединенийСкачать

Роль комплексов в различных областях
Комплексы, образованные при взаимодействии металлов с различными лигандами, играют важную роль во многих областях научных и технических исследований. Эти соединения могут быть использованы для каталитических реакций, в синтезе новых соединений, в медицине и в различных приложениях в материаловедении.
В области каталитических реакций, комплексы металлов с лигандами могут служить как катализаторы, ускоряющие химические преобразования. Например, комплексы переходных металлов с фосфинами часто используются в промышленности для синтеза органических соединений, таких как лекарственные препараты или пластические полимеры. Комплексы также могут быть использованы для селективного катализа, когда нужная реакция происходит только с определенным изомером или конкретным функциональным группировками.
В синтезе новых соединений, комплексы могут играть важную роль в образовании и стабилизации сложных структур. Они могут быть использованы для создания единичных молекул, где металл формирует связь со структурами, которые могут быть сложными или нестабильными в отсутствие комплекса. Комплексы также могут быть использованы для модификации и управления свойствами материалов, таких как проводимость или оптические свойства.
В медицине, комплексы металлов с лигандами могут быть использованы как лекарственные препараты. Некоторые комплексы могут показывать антиоксидантные, противовоспалительные или противораковые свойства. Они могут использоваться для доставки лекарственных веществ в организм или для направленного уничтожения определенных клеток или тканей.
В области материаловедения, комплексы могут быть использованы для создания новых материалов с уникальными свойствами. Например, комплексы могут быть использованы для создания наноматериалов или полимерных материалов с улучшенными механическими свойствами. Комплексы также могут быть использованы в электронике или оптике для создания устройств с особыми свойствами, такими как сверхпроводимость или ферромагнетизм.
Применение комплексов в катализе
Комплексы металлов, особенно переходных металлов, имеют широкое применение в катализе. Они играют важную роль в многих химических реакциях, ускоряя и контролируя процессы.
В катализе комплексы обеспечивают активацию и стабилизацию реагентов, образование промежуточных комплексов и ускорение реакций. Специфичность и эффективность катализатора определяют его структура и химические свойства.
Одним из основных типов катализа, в котором применяются комплексы, является гомогенный катализ. В этом случае, катализатор и реагенты находятся в одной фазе, что обеспечивает интенсивный контакт и более высокую реакционную способность. Такие комплексы могут эффективно каталитически активировать молекулы водорода, аммиака и других соединений.
Комплексы также применяются в гетерогенном катализе, где катализатор находится в другой фазе, чем реагенты. Гетерогенные катализаторы на основе комплексов имеют большую стабильность и долговечность. Они широко используются в процессах промышленного производства, таких как синтез аммиака, оксидационные реакции, гидрогенирование и дегидрирование органических соединений.
Благодаря своей специфичности катализаторы на основе комплексов могут выбирать определенные реагенты и контролировать характер реакции, увеличивая выходы желаемых продуктов. Они также способны работать при относительно низких температурах и давлениях, что снижает энергозатраты процессов и повышает их экономическую эффективность.
Инновации в области дизайна и синтеза комплексов, а также понимание их роли и механизмов работы в катализе, открывают новые возможности в разработке эффективных и выборочных катализаторов. Это способствует развитию синтетической химии, фармацевтической промышленности и других областей, где катализаторы играют важную роль.
Роль комплексов в биологии
Одна из важнейших ролей комплексов в биологии – участие в катализе реакций. Металлические комплексы могут служить активными центрами ферментов и катализировать различные биохимические реакции, такие как окислительное фосфорилирование, фотосинтез и дыхание.
Комплексы также играют ключевую роль в транспорте и хранении металлов в организме. Например, гемоглобин – комплекс содержащий железо – отвечает за транспорт кислорода в организме, а ферритин – комплекс содержащий железо – осуществляет его хранение в клетках.
Кроме того, комплексы участвуют в регуляции генетических процессов. Они могут влиять на активность генов и транскрипцию РНК, контролировать процессы клеточного деления и распространения.
Таким образом, комплексы играют значительную роль в биологии, обеспечивая регуляцию биохимических процессов, катализ реакций и транспорт металлов. Их уникальные свойства делают их незаменимыми компонентами в различных биологических системах.
📺 Видео
1.19 Типы организационных структурСкачать

Комплексные соединения. Определяем заряд комплексного иона и валентность комплексообразователя.Скачать

Комплексные соединения. 2 часть. 11 класс.Скачать

Лекция комплексные соединенияСкачать

Свойства комплексных соединений. 11 класс.Скачать

Комплексные соединенияСкачать

ФОРМЫ ГОСУДАРСТВА ЗА 13 МИНУТ. ПОЛИТИЧЕСКИЕ РЕЖИМЫ. ФОРМЫ ПРАВЛЕНИЯ. ГОСУДАРСТВЕННОЕ УСТРОЙСТВО. ЕГЭСкачать

ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Биология | Общая характеристика мхов. Мхи и лишайникиСкачать
