Химия — наука, изучающая свойства и состав веществ. Один из ее важных разделов — изучение неорганических веществ. Неорганические вещества имеют особую роль в химии, так как они не содержат углеродных соединений, которые являются основой органической химии.
Классификация неорганических веществ играет важную роль в изучении химии, так как позволяет систематизировать их многообразие. Все неорганические вещества делятся на ряд основных групп в зависимости от их химического состава и свойств.
Одной из основных групп неорганических веществ являются оксиды. Оксиды — это соединения, состоящие из кислорода и других элементов. Они широко распространены в природе и важны для многих процессов, происходящих в химии и в жизни. Оксиды могут быть кислыми, щелочными и нейтральными в зависимости от своих химических свойств и взаимодействия с водой.
Еще одной группой неорганических веществ являются соли. Соли — это соединения, состоящие из катионов и анионов. Они образуются в ходе реакции кислоты и основания и являются основными компонентами многих минералов и промышленных веществ. Соли широко используются в производстве, в медицине и в различных отраслях науки.
Таким образом, классификация неорганических веществ является важной частью изучения химии. Знание основных понятий и групп неорганических веществ поможет лучше понять химические процессы, происходящие вокруг нас, и их влияние на окружающую среду и нашу жизнь.
Видео:Классификация неорганических веществ для ОГЭСкачать

Классификация неорганических веществ 8 класс
Одна из основных классификаций неорганических веществ — это классификация по типу химической связи. Существуют три основных типа химической связи: ионная, ковалентная и металлическая. Ионные соединения образуются между ионами положительных и отрицательных зарядов. Ковалентные соединения образуются путем обмена электронами между атомами, а металлические соединения образуются между атомами металла, где электроны между атомами свободно двигаются.
Другой способ классифицировать неорганические вещества — это классификация по составу. Некоторые из главных групп неорганических веществ включают кислоты, основания, оксиды и соли. Кислоты характеризуются наличием водорода и обладают кислыми свойствами. Основания содержат гидроксидные группы и обладают щелочными свойствами. Оксиды состоят из металла и кислорода, а соли образуются путем замены одних ионов другими.
Важно помнить, что классификация неорганических веществ не является строгой и есть много исключений и специальных случаев. Однако, знание классификации неорганических веществ помогает лучше понимать химические процессы и взаимодействия между ними.
Основные понятия
В химии существуют определенные понятия, которые помогают классифицировать неорганические вещества.
1. Неорганические вещества — это вещества, которые не содержат углерод в своей основной структуре. Они могут быть как натурального, так и искусственного происхождения.
2. Элементы — это простейшие химические вещества, состоящие из одного вида атомов. Они не могут быть разложены на более простые вещества при обычных химических реакциях.
3. Соединения — это химические вещества, состоящие из двух или более элементов, объединенных определенными химическими связями. Соединения могут иметь различные структуры и свойства.
4. Кислоты — это соединения, обладающие кислотными свойствами. Они имеют специфическую структуру и могут реагировать с основаниями.
5. Основания — это соединения, обладающие щелочными свойствами. Они реагируют с кислотами, образуя соли и воду.
6. Соли — это химические соединения, образованные при реакции кислот и оснований. Они обладают специфической структурой и характерными свойствами.
7. Оксиды — это химические соединения, состоящие из элементов кислорода и других элементов. Они могут быть как кислотными, так и основными.
Эти основные понятия помогают систематизировать неорганические вещества и понять их свойства и взаимодействия.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Основные виды неорганических веществ
Основные виды неорганических веществ включают:
- Кислоты: это химические соединения, которые в растворе образуют ион водорода (H+) и отрицательный радикал.
- Основания: это химические соединения, которые в растворе образуют ион гидроксида (OH-) и положительный радикал.
- Соли: это химические соединения, образуемые из кислот и оснований путем замены ионов водорода на металлические ионы или другие положительные ионы.
- Оксиды: это химические соединения, состоящие из кислорода и одного или нескольких других элементов. Они превалируют в минеральных образованиях и могут иметь широкий спектр свойств и применений.
- Гидроксиды: это химические соединения, состоящие из гидроксильной группы (OH-) и металлического катиона.
- Аммиак: это неорганическое соединение, состоящее из азота и водорода. Оно является газообразным и обладает характерным запахом.
- Нитраты: это неорганические соединения, содержащие нитратную группу (NO3-) и металлический катион. Они широко используются в сельском хозяйстве в качестве удобрений.
Это лишь некоторые примеры неорганических веществ, их классификация включает большое количество различных соединений. Изучение каждого из этих видов неорганических веществ позволяет более полно понять их свойства и применение в различных областях науки и промышленности.
Кислоты
Кислоты широко применяются в различных отраслях жизни, в том числе в медицине, пищевой промышленности, промышленности строительных материалов и других сферах. Они играют важную роль в процессах химических реакций и взаимодействия веществ.
У кислот имеется ряд общих характеристик, которые определяют их кислотные свойства. Кислоты могут взаимодействовать с основаниями, образуя соль и воду. Они также способны образовывать водородные связи с другими веществами. Кроме того, кислоты могут действовать как окислители в химических реакциях.
Кислоты классифицируются на неорганические и органические в зависимости от состава. Неорганические кислоты образуются в результате взаимодействия неметаллов с водородом, например, серной кислоты H2SO4 или соляной кислоты HCl. Органические кислоты содержат в своем составе углерод, примерами таких кислот являются уксусная кислота CH3COOH или лимонная кислота C6H8O7.
Кислоты играют важную роль в химии и представляют собой важный объект изучения как в школьном курсе химии, так и в более глубоких научных исследованиях. Понимание свойств и классификации кислот позволяет более глубоко понять процессы химических взаимодействий и применить их в различных областях науки и технологий.
Основания
Основания обладают следующими свойствами:
- Они реагируют с кислотами, образуя соли и воду;
- Они реагируют с некоторыми неокислительными веществами, например, с нитритами, нитратами и диоксидом углерода;
- Они обладают щелочной электролитической диссоциацией в водном растворе, образуя гидроксидные ионы (OH-).
Основания могут быть как единичные вещества (например, гидроксид натрия — NaOH), так и многоатомные ионы, такие как аммоний (NH4+).
Основания используются в различных областях, таких как промышленность, медицина, сельское хозяйство и т.д. Наиболее известные основания включают гидроксиды щелочных металлов, такие как гидроксид натрия (NaOH), гидроксид калия (КОН) и гидроксид аммония (NH4ОН).
| Формула | Название |
|---|---|
| NaOH | Гидроксид натрия |
| KOH | Гидроксид калия |
| NH4OH | Гидроксид аммония |
Оксиды
Оксиды могут быть классифицированы по нескольким признакам:
По типу связи:
1. Йонные оксиды, состоящие из положительных и отрицательных ионов. Примеры: Na2O, CaO.
2. Ковалентные оксиды, где атомы вещества связаны ковалентными связями. Примеры: CO2, SO2.
3. Металлические оксиды, где кислород является мостиком между металлическими ионами. Примеры: Fe2O3, CuO.
По степени окисления:
1. Оксиды с положительным степенями окисления. Примеры: Fe2+O3, Cu2+O.
2. Оксиды с отрицательными степенями окисления. Примеры: H2O (степень окисления -2), CO2 (степень окисления 4).
По кислотности:
1. Кислые оксиды, которые реагируют с водой, образуя кислоту. Пример: SO2.
2. Основные оксиды, которые реагируют с водой, образуя основание. Пример: CaO.
3. Амфотерные оксиды, которые могут проявлять свойства и кислоты, и основания, в зависимости от условий реакции. Пример: Al2O3.
Оксиды играют важную роль в различных процессах и являются неотъемлемой частью нашей жизни. Изучение оксидов позволяет понять основные свойства и реактивность веществ.
Видео:Классификация неорганических веществСкачать

Классификация неорганических веществ
Первый класс неорганических веществ – это соли. Соли образуются из кислот и оснований при реакции нейтрализации. Они обладают регулярной кристаллической структурой и имеют высокую температуру плавления и кипения. Соли широко используются в промышленности и в повседневной жизни.
Второй класс – оксиды. Оксиды – это соединения, состоящие из металлов и кислорода. Они обладают разнообразными физическими и химическими свойствами. Некоторые оксиды являются основаниями, другие – кислотами. Оксиды широко используются в производстве стекла, керамики и металлургии.
Третий класс – кислоты. Кислоты – это соединения водорода с кислородсодержащими радикалами. Они обладают кислотными свойствами и способны реагировать с основаниями. Кислоты широко используются в производстве удобрений, пищевой промышленности и химической промышленности.
Четвертый класс – основания. Основания – это соединения, которые реагируют с кислотами и образуют соли. Они обладают щелочными свойствами и используются в качестве растворителей, щелочей и антисептиков.
Пятый класс – гидриды. Гидриды – это соединения водорода с другими элементами. Они обладают различными свойствами и используются в производстве металлов, водорода и энергетическом секторе.
Шестой класс – воды. Вода – это самое распространенное и важное неорганическое вещество на Земле. Она является растворителем для многих веществ и необходима для жизни всех организмов.
Классификация неорганических веществ позволяет систематизировать знания об их свойствах и применении. Она является основой для изучения химии и помогает понять многообразие и значимость неорганических соединений.
Аддитивная классификация
Путем анализа химического состава вещества по аддитивной системе можно определить его классификацию. Например, если вещество содержит только один элемент, то оно будет относиться к классу простых веществ. Если вещество содержит два или более различных элемента, то оно будет относиться к классу сложных веществ.
Аддитивная классификация позволяет легко определить химический состав и классификацию неорганических веществ на основе их формул. Это важный инструмент в химии, который помогает ученым и студентам систематизировать и изучать различные вещества.
Функциональная классификация
Функциональная классификация неорганических веществ основана на их химическом составе и состоит из нескольких основных групп: кислоты, основания, соли и оксиды.
Кислоты — вещества, способные образовывать положительные ионы в водных растворах. Они разделяются на бинарные и тернарные кислоты, в зависимости от количества элементов, входящих в их состав. К примеру, бинарные кислоты образуются из двух элементов, а тернарные — из трех.
Основания — вещества, способные образовывать отрицательные ионы в водных растворах. Они часто являются гидроксидами щелочных металлов или аммония. Основания также делятся на бинарные и тернарные.
Соли — вещества, образующиеся в результате реакции кислоты с основанием. Соли образуются путем замены ионов водорода в кислоте на ионы металлов или аммония.
Оксиды — химические соединения, состоящие из металлического и неметаллического элемента, связанных кислотными кислородными группами. Оксиды делятся на кислородные и некислородные.
Функциональная классификация неорганических веществ играет важную роль в изучении химии, так как позволяет систематизировать и классифицировать множество различных химических соединений, облегчая их изучение и понимание химических реакций.
Типологическая классификация
Типологическая классификация основана на общих свойствах и характеристиках веществ. При этом, неорганические вещества разделяют на отдельные группы в зависимости от их состава и структуры.
Одной из основных групп неорганических веществ являются оксиды. Это соединения, состоящие из кислорода и другого элемента. Оксиды можно подразделить на металлические и неметаллические в зависимости от того, какой элемент преобладает в соединении.
Еще одной группой неорганических веществ являются основания. Они состоят из металла и гидроксидной группы. Основания могут быть щелочными, если металл — щелочной металл, или нещелочными.
Кислоты также относятся к неорганическим веществам. Они представляют собой соединения, содержащие водород и кислород. Кислоты могут быть неорганическими или органическими в зависимости от того, содержат ли они кислород в карбоновой или некарбоновой форме.
Ионы и растворы также можно отнести к типологической классификации неорганических веществ. Ионы — это заряженные частицы, образующиеся в результате диссоциации вещества в водном растворе. Растворы могут быть кислыми, щелочными или нейтральными в зависимости от содержания ионов в них.
Типологическая классификация удобна для общего представления о химических соединениях и их свойствах. Она позволяет систематизировать наблюдаемые явления и упростить понимание неорганической химии.
| Группа неорганических веществ | Примеры |
|---|---|
| Оксиды | оксид кальция (CaO), оксид алюминия (Al2O3) |
| Основания | гидроксид натрия (NaOH), гидроксид калия (KOH) |
| Кислоты | серная кислота (H2SO4), соляная кислота (HCl) |
| Ионы и растворы | ионы гидроксида (OH-), раствор соляной кислоты (HCl) |
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Примеры неорганических веществ
1. Вода (H2O)
Вода – неорганическое соединение, состоящее из атомов водорода и кислорода. Она является жизненно важным веществом для всех организмов на Земле, играет важную роль в химических реакциях и обладает уникальными свойствами.
2. Сода (NaHCO3)
Сода – это соль, состоящая из натрия (Na), водорода (H), углерода (C) и кислорода (O). Ее используют в кулинарии, медицине и бытовых целях. Сода может использоваться для приготовления пищи, очищения и дезинфекции, а также для лечения некоторых заболеваний.
3. Диоксид углерода (CO2)
Диоксид углерода – это неорганическое соединение, состоящее из одного атома углерода (C) и двух атомов кислорода (O). Он является продуктом многих химических реакций и распространен в атмосфере Земли. Диоксид углерода также является главным газом, вызывающим парниковый эффект и влияющим на климат.
4. Сера (S)
Сера – химический элемент, неорганическое вещество, присутствующее в ряде минералов и органическом веществе, таком как серосодержащие аминокислоты. Сера используется в различных отраслях – в производстве удобрений, в производстве горючих материалов и в медицине.
Это лишь некоторые примеры неорганических веществ. Изучение и классификация неорганических веществ помогает нам понять их свойства и использование в разных областях науки и технологии.
Сульфаты
В природе сульфаты встречаются широко, особенно в виде минералов. Некоторые известные минералы, содержащие сульфаты, включают гипс, эпсомит и ангидрит.
Сульфаты имеют различные применения в промышленности и других сферах. Например, сернокислый магний (MgSO4), более известный как эпсом соль, используется в медицине, косметике и сельском хозяйстве.
Сульфаты также играют важную роль в химических процессах. Например, алюминий может образовывать различные сульфаты, такие как алюминийсульфат (Al2(SO4)3), используемый в процессе очистки воды и производстве бумаги.
Познакомившись с основными понятиями о сульфатах и их свойствах, можно более глубоко изучить неорганическую химию и лучше понять, какие вещества встречаются в нашей повседневной жизни и промышленности.
Карбонаты
Одним из наиболее известных карбонатов является кальцийкарбонат (CaCO3), который представлен такими минералами, как мрамор, известняк и ракушечник. Он широко используется в строительстве и производстве цемента.
Еще одним распространенным карбонатом является натрийкарбонат (Na2CO3), он известен под названием пищевая сода. Он широко применяется в пищевой, химической и стекольной промышленности.
Другие важные карбонаты включают магнийкарбонат (MgCO3), аммонийкарбонат ((NH4)2CO3), калийкарбонат (K2CO3) и многие другие.
Карбонаты имеют свойства щелочей и образуют щелочные растворы, которые могут нейтрализовать кислоты. Они также могут реагировать с другими солями, образуя осадки или растворяясь в воде.
Изучение карбонатов в химии помогает понять их свойства и применение в различных отраслях промышленности и науке.
💥 Видео
ВСЯ ХИМИЯ С НУЛЯ! | Денис Марков | УмскулСкачать

ВСЯ неорганическая классификация за 45 минут! | Химия ОГЭ 2023 | УмскулСкачать

39. Классы неорганических соединенийСкачать

Генетическая связь между классами неорганических веществ. Видеоурок по химии 8 классСкачать

Генетическая связь между классами неорганических веществ. Химия 8 классСкачать

КИСЛОТЫ ХИМИЯ // Урок Химии 8 класс: Кислоты, Кислотный Остаток, Классы Неорганических СоединенийСкачать

ВАЛЕНТНОСТЬ 8 КЛАСС ХИМИЯ // Урок Химии 8 класс: Валентность Химических ЭлементовСкачать

Оксиды. 1 часть. 8 класс.Скачать
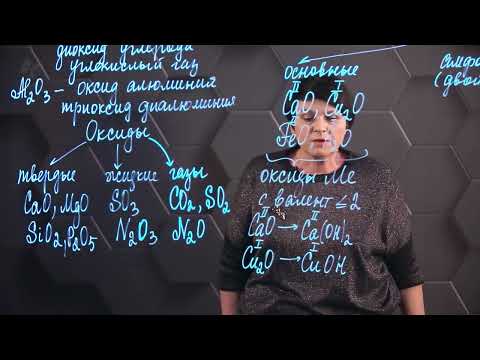
Все классы в неорганике за 6 часов | Химия ЕГЭ 2023 | УмскулСкачать

ЭТО НУЖНО ЗНАТЬ — Химия с нуля, Основные Химические ПонятияСкачать

12. Органические и неорганические веществаСкачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Классификация неорганических веществСкачать

Классификация неорганических соединений | Химия ОГЭ 2022 | УмскулСкачать

СОЛИ ХИМИЯ 8 КЛАСС // Урок Химии 8 класс: Классификация солей, Формулы Солей, Кислотный ОстатокСкачать
