Протеины играют ключевую роль в организме человека и других организмов. Они выполняют множество функций, участвуя в процессах, таких как рост, развитие и обеспечение полноценной работы органов и систем.
Структура протеина представляет собой упорядоченную последовательность аминокислот. Основными компонентами протеина являются 20 различных аминокислот, каждая из которых выполняет свою уникальную роль в формировании трехмерной структуры протеина.
Протеинная структура состоит из трех уровней: первичная, вторичная и третичная. Первичная структура определяется последовательностью аминокислот в протеине и является самым простым уровнем организации. Вторичная структура включает в себя формирование спиралей (альфа-спираль) и протяженных сегментов (бета-складки), которые определяются взаимодействием атомов аминокислот внутри молекулы протеина.
Третичная структура протеина — это трехмерная форма, в которой аминокислоты взаимодействуют между собой, образуя сложные связи, такие как водородные связи и гидрофобные взаимодействия. Эти взаимодействия определяют форму и функцию протеина.
Изучение структуры протеина имеет огромное значение для понимания его свойств и функций. Благодаря современным методам анализа структуры протеинов, ученым удалось раскрыть множество загадок о работе организма, что открывает новые перспективы для разработки новых лекарств и технологий.
- Что такое протеин?
- Основные компоненты протеина
- Аминокислоты и их роль
- Пептидные связи между аминокислотами
- Структура протеина
- Первичная структура протеина
- Вторичная структура протеина
- Третичная структура протеина
- Кватерническая структура протеина
- Свойства протеина
- Растворимость в воде
- Денатурация протеина
- Биологическая активность протеина
- 🎬 Видео
Видео:Структура белковСкачать

Что такое протеин?
Структурная роль протеинов заключается в формировании различных структурных элементов клеток и тканей, таких как головки миозина в мышцах или коллаген в соединительной ткани. Протеины также играют важную каталитическую роль, участвуя в биохимических реакциях организма. Они действуют в качестве ферментов, ускоряя протекание реакций и обеспечивая их контроль. Кроме того, протеины играют ключевую роль в транспорте других молекул и веществ по организму, например, гемоглобин переносит кислород в крови. Наконец, протеины являются регуляторами биологических процессов, влияя на активность генов и сигнальные пути.
Протеин может быть представлен как обычная цепочка из аминокислот, каждая из которых имеет свою уникальную структуру и свойства. Тримеры протеинов, состоящие из трех подразделов, могут образовывать комплексы, называемые кватернерами. Протеины могут иметь различные формы, включая глобулы, спиралевидные структуры и сложные многомерные эдактили и гелики. Все эти структуры связаны с конкретными функциями протеинов и их взаимодействием с другими биологическими молекулами.
| Основные свойства протеинов |
|---|
| Взаимодействие с другими молекулами |
| Распознавание и связывание субстратов |
| Передача сигналов |
| Коагуляция и стабилизация |
Видео:Строение и уровни структурной организации белков. 10 класс.Скачать

Основные компоненты протеина
Строительные блоки протеина соединяются между собой пептидными связями, создавая цепочку аминокислот. Эта цепочка может иметь различные длины и конфигурации, что определяет конкретную форму протеина.
Некоторые аминокислоты в протеине могут быть химически модифицированы, что может повлиять на его свойства и функцию. Например, метилирование или ацетилирование аминокислоты может изменить ее взаимодействие с другими молекулами.
Кроме аминокислот, в протеине также могут присутствовать другие компоненты, такие как хромофоры, кофакторы или посттрансляционные модификации, которые могут влиять на его структуру и функцию.
Изучение основных компонентов протеина позволяет лучше понять его структуру и функцию, а также раскрыть механизмы, лежащие в основе его взаимодействия с другими молекулами и участие в различных биологических процессах. Протеины играют важную роль в жизни клетки и организма в целом, поэтому изучение их структуры и свойств является одной из основных задач биохимии и молекулярной биологии.
Аминокислоты и их роль
У человека есть 20 различных аминокислот, и они могут комбинироваться в разных последовательностях, образуя протеины. Каждая аминокислота имеет свойственные ей свойства и функции.
Аминокислоты разделяются на две категории: незаменимые и заменимые. Незаменимые аминокислоты не могут быть синтезированы организмом и поэтому должны поступать извне через пищу. Представители незаменимых аминокислот включают лейцин, изолейцин, валин, треонин, фенилаланин, метионин, триптофан и лизин. Заменимые аминокислоты могут быть синтезированы организмом из других аминокислот или молекул. Их представители включают аланин, аргинин, аспарагин, аспарагиновую кислоту, глутамин, глютаминовую кислоту, глицин, пролин, серин и тирозин.
Аминокислоты имеют различные функции в организме. Они участвуют в синтезе протеинов, которые являются основными строительными блоками тканей и органов. Аминокислоты также являются энергетическими источниками и участвуют в метаболических процессах. Некоторые аминокислоты играют роль нейромедиаторов, передающих сигналы в нервной системе. Кроме того, аминокислоты участвуют в биосинтезе гормонов, ферментов и других биологически активных веществ.
| Название аминокислоты | Свойства и функции |
|---|---|
| Лейцин | Участвует в синтезе протеинов, регулирует рост и развитие мышц |
| Глутамин | Способствует улучшению иммунной функции, поддерживает здоровье пищеварительной системы |
| Глицин | Участвует в синтезе коллагена, глюкозы и глутатиона, улучшает сон и память |
| Триптофан | Необходим для синтеза серотонина, который регулирует настроение и сон |
| Лизин | Участвует в синтезе коллагена и карнитина, поддерживает здоровье кожи и суставов |
Разнообразие аминокислот и их функций подчеркивает важность употребления разнообразной пищи, содержащей все необходимые аминокислоты. Недостаток определенных аминокислот может привести к различным заболеваниям и проблемам со здоровьем. Поэтому важно обеспечивать организм всеми необходимыми аминокислотами через правильное питание.
Пептидные связи между аминокислотами
Пептидные связи имеют особую важность для структуры протеина, так как они образуют основную «скелетную» часть протеина — полипептидную цепь. Пептидные связи между аминокислотами обладают высокой стабильностью и позволяют протеину принимать определенную пространственную конформацию.
Пептидные связи обладают несколькими важными свойствами. Во-первых, они являются плоскими и линейными, что позволяет протеину принимать характерную спиральную форму — альфа-спираль или бета-спираль. Во-вторых, пептидные связи обладают частично двойной характер, так как электроны амидных связей могут находиться как в плоскости бонда, так и над ним.
Знание о пептидных связях и их свойствах позволяет углубить понимание строения и свойств протеинов. Исследования в этой области полезны для научных исследований и развития новых методов и технологий в биохимии и фармакологии.
Видео:PROСТО О СЛОЖНОМ. Белки и их структуры. Биохимия №1Скачать

Структура протеина
Структура протеина имеет несколько уровней организации: первичная, вторичная, третичная и кватернарная.
Первичная структура – это последовательность аминокислот в пептидной цепи. Она определяется генетической информацией в ДНК и РНК. Вторичная структура образуется благодаря взаимодействию аминокислотных остатков и может быть альфа-спиралью или бета-складываемой структурой. Третичная структура – это пространственное расположение пептидной цепи, связанное с дальнейшими взаимодействиями аминокислотных остатков. Кватернарная структура – это связывание нескольких пептидных цепей в одну функциональную единицу.
Протеины обладают различными свойствами и функциями, которые определяются их структурой. Некоторые протеины являются структурными компонентами клеток и тканей, другие – ферментами, которые участвуют в реакциях обмена веществ. Также протеины могут быть гормонами, иммуноглобулинами и транспортными молекулами, выполняющими различные важные функции в организме.
| Уровень структуры | Описание |
|---|---|
| Первичная структура | Последовательность аминокислот в пептидной цепи |
| Вторичная структура | Пространственное расположение аминокислотных остатков в пептидной цепи |
| Третичная структура | Пространственное расположение пептидной цепи в пространстве |
| Кватернарная структура | Образование комплексов из нескольких пептидных цепей |
Первичная структура протеина
Первичная структура протеина представляет собой упорядоченную последовательность аминокислотных остатков. Она определяет конкретный порядок аминокислот, из которых состоит протеин. Эта структура играет важную роль в функционировании белка и его взаимодействии с другими молекулами.
Первичная структура протеина определяется последовательностью нуклеотидов в гене, которая затем транслируется в последовательность аминокислот. Каждый аминокислотный остаток связывается с соседним через пептидные связи, образуя цепочку.
Первичная структура протеина может быть представлена в форме аминокислотной последовательности, где каждый аминокислотный остаток обозначается сокращенным кодом. Например, глицин обозначается буквой «G», лейцин — буквой «L» и т.д. Такая последовательность может быть очень длинной и сложной.
Первичная структура протеина является основой для формирования вторичной, третичной и кватернарной структур протеина. Определение первичной структуры является важным шагом в изучении белков и понимании их функций.
Изменение первичной структуры протеина может привести к нарушению его нормального функционирования и вызвать различные заболевания. Поэтому исследование первичной структуры протеина имеет большое значение для медицины и биохимии.
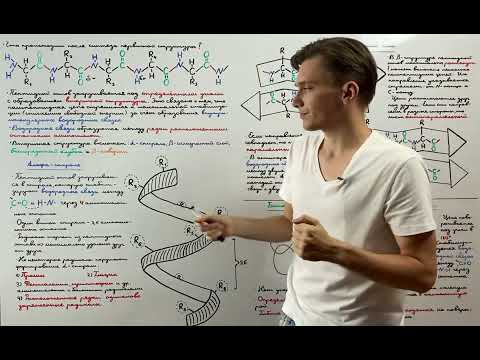
Вторичная структура протеина
Вторичная структура протеина представляет собой пространственную организацию аминокислотных остатков в цепи. Она формируется благодаря взаимодействию близко расположенных аминокислотных остатков внутри молекулы протеина. Вторичная структура может быть представлена в виде α-спиралей и β-складок.
Альфа-спираль образуется при вращении аминокислотных остатков вокруг оси молекулы протеина. Они формируют стабильные водородные связи между аминокислотными остатками, обеспечивающие прочность и устойчивость структуры.
Бета-складка представляет собой параллельное или антипараллельное связывание непосредственно смежных цепей аминокислотных остатков. Возникающие при этом водородные связи позволяют остаткам аминокислот принять стабильную пространственную конфигурацию.
Вторичная структура протеина влияет на его функцию и взаимодействие с другими молекулами. Она обладает ключевой ролью в формировании третичной и кватернической структуры протеина.
| Вторичная структура | Описание |
|---|---|
| α-спираль | Вращение цепи вокруг своей оси |
| β-складка | Связывание параллельных или антипараллельных цепей |
Третичная структура протеина
Третичная структура обусловлена взаимодействием боковых цепей аминокислот и может быть подразделена на несколько уровней организации: структурные элементы, такие как альфа-спираль, бета-складка, бета-поворот и лицевая плоскость, а также домены и супердомены.
В структурные элементы входят также шариковые клубки, где боковые цепи располагаются внутри и вне клубков, аминокислоты принимают плоские конформации и образуют стабильные водородные связи. Домены представляют собой некоторые отдельные регионы в структуре, которые обладают своей уникальной конформацией и могут выполнять определенные функции. Супердомены – это области в протеиновой цепи, объединяющие несколько доменов.
Третичная структура протеина удерживается силами взаимодействия между атомами, такими как водородные связи, электростатические взаимодействия, вани-дер-Ваальсовы силы и гидрофобные взаимодействия. Эти взаимодействия обеспечивают стабильность протеина и его способность к выполнению определенной функции в клетке.
Третичная структура протеина имеет важное значение для его свойств и функций, поэтому изучение этого уровня организации протеина является важной задачей в биохимии и структурной биологии.
Кватерническая структура протеина
Каждый неуклюжечка состоит из цепочки аминокислот и свяжется с другими неуклюжецами, формируя так называемые структурные мотивы. Эти мотивы имеют ключевое значение в определении функции протеина, так как они образуют функциональные центры, взаимодействуют с другими биомолекулами и осуществляют конкретные биологические процессы.
Взаимодействия между неуклюжецами и структурными мотивами происходят через гидрофобные, электростатические и водородные связи, с помощью которых формируются пространственные узлы протеина.
| Свойства кватернической структуры | Описание |
|---|---|
| Стабильность | Кватерническая структура обладает высокой устойчивостью и сохраняет свою трехмерную форму в различных условиях. |
| Взаимодействия | Кватерническая структура обеспечивает взаимодействие различных функциональных центров протеина и позволяет ему выполнять свои биологические функции. |
| Гибкость | Некоторые участки кватернической структуры могут быть гибкими и позволять протеину принять различные конформации, что важно для его функциональной активности. |
Кватерническая структура протеина является одной из важных особенностей его строения, так как она объединяет несколько полипептидных цепей и обеспечивает формирование сложной трехмерной архитектуры протеинового молекулы.
Видео:Биосинтез белка за 3 минуты (даже меньше)Скачать

Свойства протеина
1. Высокая специфичность структуры и функции: каждый протеин обладает определенной структурой и выполняет конкретные функции в организме. Малейшее изменение в составе аминокислот может привести к нарушению работы протеина и возникновению заболеваний.
2. Разнообразие функций: протеины выполняют множество ролей в организме, такие как транспортные функции (например, гемоглобин переносит кислород), каталитические функции (ферменты, которые участвуют в химических реакциях), структурные функции (структура коллагена определяет прочность соединительной ткани) и др.
3. Взаимодействие соединений и молекул: протеины взаимодействуют с другими биомолекулами, такими как нуклеиновые кислоты, липиды и углеводы. Такие взаимодействия играют важную роль в биологических процессах, таких как синтез ДНК, передача сигналов и транспорт веществ в клетках.
4. Изменение свойств в зависимости от условий: протеины могут менять свою конформацию и функции в ответ на изменения в окружающей среде, такие как pH, температура и присутствие веществ, таких как лиганды. Это позволяет им регулировать и адаптироваться к различным условиям и функционировать в организме.
Растворимость в воде
Растворимость протеинов зависит от различных факторов, включая аминокислотный состав, структуру и взаимодействия с другими молекулами. Гидрофильные аминокислоты, такие как серин, треонин и глутаминовая кислота, увеличивают растворимость протеина в воде.
Наоборот, гидрофобные аминокислоты, такие как валин, изолейцин и лейцин, снижают растворимость протеина в воде. Гидрофобные области протеинов могут образовывать внутренние гидрофобные среды, что препятствует взаимодействию с водой и снижает растворимость.
Помимо аминокислотного состава, структура протеина также влияет на его растворимость в воде. Неорганизованные, неправильно свернутые протеины могут иметь плохую растворимость в воде. С другой стороны, правильно свернутые протеины с оптимальной структурой могут быть лучше растворимыми в воде.
Растворимость протеина в воде также может быть изменена изменением pH или добавлением солей. Некоторые протеины могут растворяться лучше при определенных значениях pH, в то время как другие могут выпадать из раствора. Добавление солей также может изменить растворимость протеина, так как соли могут конкурировать с протеинами за интеракции с водой.
Растворимость протеина в воде играет важную роль в его функциональности и взаимодействии с другими молекулами в организме. Понимание факторов, влияющих на растворимость протеина, может помочь в разработке новых технологий и исследовании белковых систем.
Денатурация протеина
Денатурация протеина может быть вызвана различными факторами, такими как высокая температура, изменение pH, наличие органических растворителей или сильных химических веществ. В результате воздействия этих факторов, связи между аминокислотными остатками протеина, такие как водородные связи, гидрофобное взаимодействие и сольные мостики, разрушаются.
Денатурация протеина может иметь различные последствия. Во-первых, структурные изменения в протеине могут привести к потере его биологической активности. Некоторые протеины, такие как ферменты, могут перестать катализировать реакции после денатурации. Кроме того, денатурированный протеин может потерять свою растворимость и стать нерастворимым в воде или других растворителях.
Однако, не все типы денатурации протеина необратимы. Некоторые протеины могут восстановить свою структуру и функциональность после удаления воздействующего фактора. Этот процесс называется рефолдингом. В некоторых случаях, рефолдинг может быть спонтанным, а в других — требовать участия других белков или факторов.
Важно отметить, что денатурация протеина — это обратимый процесс и структура протеина может быть восстановлена в оптимальных условиях. Однако, индивидуальные характеристики протеинов и условия денатурации могут влиять на возможность и эффективность рефолдинга.
Биологическая активность протеина
Одна из самых важных особенностей протеинов – их способность проявлять биологическую активность. Это означает, что протеины могут взаимодействовать с другими молекулами в организме, вызывая различные биохимические реакции и эффекты.
Протеины обладают разнообразной биологической активностью. Они могут быть ферментами, катализирующими химические реакции в организме. Ферменты играют важную роль в обмене веществ, синтезе биологически активных веществ, детоксикации и других процессах.
Некоторые протеины являются гормонами, которые контролируют жизненно важные процессы в организме, такие как рост и развитие, регуляция обмена веществ, репродуктивная функция и др. Примером таких протеинов являются инсулин, гормональные ферменты и регуляторы гена.
Протеины также могут служить структурными элементами организма. Они обеспечивают прочность и эластичность клеток, тканей и органов, участвуют в формировании костей, хрящей, мышц и других структур. Примерами таких протеинов являются коллаген, эластин и миозин.
Биологическая активность протеина может проявляться через взаимодействие с другими белками, молекулами нуклеиновых кислот, липидами и другими биологическими макромолекулами. Эти взаимодействия играют важную роль в жизнедеятельности организма и обеспечивают его нормальное функционирование.
🎬 Видео
Строение и функции белков.Скачать

Первичная структура белкаСкачать

Белки. Их свойства и функции. 8 класс.Скачать

Л.7 | БЕЛКИ | Состав и строение белков | ОБЩАЯ БИОЛОГИЯ ЕГЭСкачать

Белки - виды аминокислот, суточная потребностьСкачать

Структуры белкаСкачать

Функции белков. Видеоурок по биологии 10 классСкачать

Белки | Биология 10 класс #8 | ИнфоурокСкачать

ЛУЧШЕЕ ВИДЕО ПРО ПРОТЕИН! КАК ПРИНИМАТЬ протеин. ВРЕД и ПОЛЬЗА протеина. КАКОЙ протеин ВЫБРАТЬСкачать

Белки. 10 класс.Скачать

10 класс - Биология - Строение и функции белков в клеткеСкачать

Аминокислоты, белки. Строение белков. Уровни организации белковой молекулы. Видеоурок по биологии 10Скачать

ЛЕКЦИЯ 4. АМИНОКИСЛОТЫ, БЕЛКИСкачать

2. Всё про белок за 5 минутСкачать

Вторичная структура белкаСкачать
Белки. Структура белковых молекул. 11 класс.Скачать
