Натрий хлорид, наиболее известный как обычная столовая соль, является одним из наиболее распространенных химических соединений. Он является бинарным соединением, состоящим из двух элементов: натрия (Na) и хлора (Cl). Известно, что натрий хлорид имеет характерную кристаллическую структуру, состоящую из ионов натрия и ионов хлора, которые могут быть сформированы из отдельных атомов.
Натрий и хлор, входящие в состав натрия хлорида, обладают уникальными свойствами. Натрий, алкалий металл, является очень реактивным элементом с белым металлическим блеском и мягкой консистенцией. Хлор, неметалл, является ярко-желтого цвета газом, обладающим высокой реактивностью и отсутствием вкуса и запаха.
Соединение натрия хлорида пользуется широким спросом в промышленности и пищевой отрасли. Благодаря его высокой стабильности и низкой стоимости, натрий хлорид используется в качестве пищевого добавки, консерванта и средства для усиления вкуса продуктов. Он также используется при производстве пищевых консервов и соленых закусок.
- Что такое натрий хлорид?
- Определение и основные свойства
- История открытия и применение
- Как образуется натрий хлорид?
- Процесс синтеза и химические реакции
- Естественное происхождение и осадочные образования
- Кристаллическая структура натрия хлорида
- Позиция в периодической таблице элементов
- Расположение и форма молекулы
- Физические свойства натрия хлорида
- Внешний вид и физическая плотность
- Температура плавления и кипения
- Химические свойства натрия хлорида
- Реакция с водой и образование солей
- Воздействие на органические вещества
- Применение натрия хлорида в медицине
- Роль в регуляции водно-солевого равновесия
- Использование в инфузионной терапии
- Применение натрия хлорида в пищевой промышленности
- Как консервант и антисептик
- Добавление в пищевые продукты и приправы
- Применение натрия хлорида в промышленности
- Применение в производстве химических веществ
- 📽️ Видео
Видео:натрия хлорид инструкция по применениюСкачать

Что такое натрий хлорид?
Обычно натрий хлорид представляет собой белую или бесцветную кристаллическую соль, без запаха. Она легко растворяется в воде и многих других растворителях, таких как спирт или этиловый и изопропиловый спирты. Это делает натрий хлорид удобным и универсальным реагентом в химической лаборатории и в процессах производства.
Кроме того, натрий хлорид является неотъемлемым продуктом в пищевой промышленности, где он используется как приправа и консервант благодаря своим антимикробным свойствам. Благодаря низкой стоимости и доступности натрий хлорид является одним из наиболее широко используемых химических соединений в мире.
| Химическая формула | NaCl |
|---|---|
| Молекулярный вес | 58.44 г/моль |
| Внешний вид | Белые или бесцветные кристаллы |
| Плотность | 2.165 г/см³ |
| Температура плавления | 801 градус Цельсия |
| Температура кипения | 1465 градусов Цельсия |
Определение и основные свойства
Физические свойства натрия хлорида:
- Белый кристаллический порошок или кристаллы с гранями.
- Растворяется хорошо в воде и образует прозрачный раствор.
- Обладает соленоватым вкусом и характерным запахом.
- Точка плавления составляет около 801 °C, а точка кипения – около 1465 °C.
- Хорошо проводит электричество в расплавленном состоянии и в водном растворе.
Химические свойства натрия хлорида:
- Является сильным электролитом и проводит электрический ток в растворе.
- Может взаимодействовать с многими другими веществами, образуя различные химические соединения.
- Устойчив в обычных условиях, не подвержен окислению или разложению.
- Является несгораемым и неокисляемым веществом.
Натрий хлорид широко используется в пищевой промышленности, в медицине, в косметической промышленности и в производстве хлора и натрия. Он также играет важную роль в регуляции электролитного баланса в организме человека, а также придает пище соленый вкус и помогает улучшить вкусовые качества многих блюд.
История открытия и применение
Натрий хлорид, также известный как каменная соль или поваренная соль, был открыт в древние времена и широко использовался в различных областях.
В истории египтян, греков и римлян натрий хлорид был ценным товаром, используемым для консервирования пищи, приготовления различных блюд и для медицинских целей. Благодаря своим антимикробным свойствам, натрий хлорид использовался для лечения ран и инфекций.
С течением времени натрий хлорид стал одним из самых распространенных и важных продуктов на нашей планете. Также известный как поваренная соль, он широко применяется в пищевой промышленности для консервации и приготовления пищи. Кроме того, натрий хлорид используется в медицинских целях, для создания растворов для инъекций и промывания ран.
В сельском хозяйстве натрий хлорид используется как удобрение для повышения плодородия почвы. Кроме того, он используется в промышленности для производства хлора, соли и других химических продуктов.
В конечном итоге, натрий хлорид не только оказался важным компонентом нашей повседневной жизни, но и прочно занял свое место в истории и культуре человечества.
Видео:Натрия хлорид раствор инструкция по применению препарата: Показания, как применять, обзор препаратаСкачать

Как образуется натрий хлорид?
Натрий хлорид, наиболее известный как кухонная соль, образуется путем химической реакции между хлором и натрием. Общее уравнение этой реакции выглядит следующим образом:
2 Na + Cl2 -> 2 NaCl
Эта реакция происходит при нагревании и электролизе.
При нагревании хлор реагирует с металлическим натрием, образуя натрий хлорид:
- 2 Na + Cl2 -> 2 NaCl
При электролизе раствора хлорида натрия также получается натрий хлорид:
- 2 Na+ + 2 Cl— -> 2 NaCl
Натрий хлорид имеет кристаллическую структуру и образует кубические кристаллы, которые легко растворяются в воде. Он является ионным соединением, состоящим из натриевых и хлоридных ионов. Натрий является положительным ионом, а хлорид — отрицательным ионом. Натрий хлорид широко используется в пищевой промышленности, медицине, в процессе приготовления пищи и в других сферах деятельности.
Процесс синтеза и химические реакции
Натрий хлорид, также известный как поваренная соль или каменная соль, образуется при химической реакции между натрием (Na) и хлором (Cl). Этот процесс называется синтезом.
Синтез натрия хлорида обычно происходит при высоких температурах, чтобы обеспечить полное соединение элементов. В этом процессе натрий сначала проходит экзотермическую реакцию с хлором, образуя натрий хлорид и высвобождая энергию.
Химическое уравнение для реакции синтеза натрия хлорида выглядит следующим образом:
- 2Na + Cl2 → 2NaCl
Эта реакция является обратимой, что означает, что натрий хлорид может взаимодействовать с другими веществами и обратно разложиться на натрий и хлор. Например, нагревание натрия хлорида с серной кислотой (H2SO4) может привести к образованию соляной кислоты (HCl) и серы (S).
Важно отметить, что натрий хлорид является ионным соединением, состоящим из положительных ионов натрия (Na+) и отрицательных ионов хлора (Cl—). Эти ионы имеют электрический заряд и могут служить для проведения электричества в растворе натрия хлорида или в расплавленной форме.
Естественное происхождение и осадочные образования
Основным источником натрия хлорида являются морские воды, где содержится огромное количество растворенной соли. Когда морская вода испаряется под воздействием солнечного света и ветра, происходит отделение натрия и хлора, и натрий хлорид выделяется в виде солевых осадков. Это может происходить в естественном или искусственном резервуарах, таких как соленые озера или соленые пустыни.
Натрий хлорид также может образовываться в результате процессов гидротермальной активности, когда вулканическая магма взаимодействует с подземными водами, богатыми хлоридами. При таких условиях происходит химическая реакция, в результате которой образуется натрий хлорид, иногда вместе с другими минералами.
Осадочные образования, содержащие натрий хлорид, также происходят в результате испарения пресных вод, содержащих растворенную соль. Это может быть осадок в соленых озерах, пещерах или подземных водоносных пластах. Такие соляные образования могут иметь различные формы — от кристаллических скоплений до слоистых осадочных пород.
Натрий хлорид имеет ряд уникальных свойств, которые обусловлены его структурой и химическим составом. Этот минерал имеет кубическую кристаллическую решетку, которая придает ему кубическую форму. Он также обладает высокой растворимостью в воде и способен образовывать гигроскопические кристаллы, которые легко впитывают влагу из окружающей среды.
В целом, натрий хлорид является важным минералом для человека, который широко используется в пищевой промышленности, медицине, химической промышленности и других областях. Его естественное происхождение и осадочные образования делают его доступным из различных источников, что позволяет его широкое использование в промышленности и повседневной жизни.
Видео:Что такое физраствор и для чего он нужен?Скачать

Кристаллическая структура натрия хлорида
В кристаллической структуре натрия хлорида натрий и хлор расположены в узлах кубической решетки. Каждый ион натрия окружен шестью ионами хлорида, а каждый ион хлорида – шестью ионами натрия. Таким образом, каждый ион в решетке связан с окружающими ионами через сильные электростатические силы, обусловленные различием зарядов.
Кристаллическая структура натрия хлорида образует регулярную решетку, в которой все ионы расположены в фиксированных положениях. Благодаря этому, натрий хлорид обладает высокой стабильностью и кристаллической устойчивостью.
Кристаллическая структура натрия хлорида также объясняет его прочные и твердые свойства. Кристаллическая решетка обеспечивает устойчивое расположение ионов и предотвращает их перемещение, что делает натрий хлорид твердым веществом при комнатной температуре.
В целом, кристаллическая структура натрия хлорида играет важную роль в его химических и физических свойствах, определяя его устойчивость, твёрдость и растворимость.
Позиция в периодической таблице элементов
Расположение и форма молекулы
Молекула натрия хлорида (NaCl) представляет собой кристаллическую структуру, состоящую из ионов натрия (Na+) и хлорида (Cl-). Натрий и хлор принадлежат к группе щелочных и щелочноземельных металлов и галогенов соответственно.
Молекула NaCl обладает простой кубической структурой. Атом натрия (Na) находится в центре куба, а атом хлора (Cl) окружает его со всех сторон. Каждому атому натрия соответствует 6 атомов хлора, и наоборот. Таким образом, молекула NaCl образует кристаллическую решётку.
Молекулы NaCl обладают высокой симметрией, так как все ионы натрия и хлора располагаются на равных расстояниях друг от друга. Угол между соединяющими ионы линиями в кристаллической решетке NaCl равен 90 градусов.
Расположение и форма молекулы NaCl определяют её уникальные химические и физические свойства. Натрий хлорид широко используется в медицине, пищевой промышленности, химии и других отраслях народного хозяйства.
Видео:Роль натрия в организме ► Что происходит с организмом при нехватке натрия?🤔Скачать

Физические свойства натрия хлорида
1. Внешний вид: натрий хлорид представляет собой безцветные или белые кристаллы, которые могут быть в форме кубов, октаэдров или зерен.
2. Температура плавления: натрий хлорид плавится при температуре около 801 градуса Цельсия. При плавлении он образует прозрачную жидкость.
3. Температура кипения: при нормальных условиях натрий хлорид не кипит, но при повышении температуры жидкий натрий хлорид может испаряться.
4. Растворимость: натрий хлорид хорошо растворяется в воде и образует раствор соли. Этот раствор обладает солоноватым вкусом.
5. Плотность: плотность натрия хлорида составляет около 2,165 г/см³. Он является плотным материалом.
6. Ломкость: натрий хлорид имеет хрупкую структуру и может легко разломиться на кристаллы.
7. Специфическая теплоемкость: теплоемкость натрия хлорида составляет около 0,773 Дж/г°С. Это значение показывает, что для повышения температуры натрия хлорида на 1 градус Цельсия требуется 0,773 Дж энергии.
Физические свойства натрия хлорида делают его полезным в различных областях, таких как пищевая промышленность, медицина, химическая промышленность и другие.
Внешний вид и физическая плотность
Физическая плотность натрия хлорида составляет около 2,16 г/см³. Это означает, что данное соединение имеет высокую плотность и тяжеловесное по сравнению с водой. Кристаллы натрия хлорида имеют хрупкую структуру и легко растворяются в воде, образуя прозрачные растворы. Они также растворимы в ряде других растворителей, таких как спирты и аммиак.
Температура плавления и кипения
Натрий хлорид имеет высокую температуру плавления и кипения. Температура плавления натрия хлорида составляет около 801 градуса Цельсия, что делает его одним из самых высокотемпературных солей. Это связано с сильными ионными связями между натрием и хлором.
Температура кипения натрия хлорида достигает примерно 1413 градусов Цельсия. Это очень высокая температура, которую можно достичь только при использовании специального оборудования, такого как печи и кристаллизаторы.
Высокая температура плавления и кипения позволяет использовать натрий хлорид в различных областях промышленности, таких как производство стекла, химическое производство и металлургия.
Видео:Силикат натрия или жидкое стекло! (Химические эксперименты)Скачать

Химические свойства натрия хлорида
Основные химические свойства натрия хлорида включают:
- Растворимость: Натрий хлорид обладает высокой растворимостью в воде. При растворении он диссоциирует на ионы натрия (Na+) и хлора (Cl-), что делает его электролитом.
- Стабильность: Натрий хлорид является стабильным соединением при нормальных условиях окружающей среды. Он обладает высокими температурной и химической устойчивостью.
- Нейтральность: Натрий хлорид обладает нейтральным pH и не обладает кислотными или щелочными свойствами.
- Ионные свойства: Ионы натрия и хлорида, образованные при растворении натрия хлорида, обладают электроотрицательными и электроположительными свойствами соответственно. Ионный характер натрия хлорида позволяет ему участвовать в различных химических реакциях и оказывать важное влияние на биологические процессы в организме.
Натрий хлорид является одним из наиболее распространенных химических соединений и широко используется в различных отраслях промышленности, вещественной медицине и пищевой промышленности. Его химические свойства делают его важным компонентом в процессах, связанных с растворением и электролитическими реакциями.
Реакция с водой и образование солей
Когда натрий хлорид растворяется в воде, происходит реакция, в результате которой ионы натрия (Na+) и ионы хлорида (Cl-) разделяются.
| Реакция | Уравнение реакции |
|---|---|
| Растворение натрия хлорида в воде | NaCl (s) + H2O(l) → Na+(aq) + Cl—(aq) |
Разделение ионов происходит благодаря полярности молекулы воды.
Молекула воды содержит две соседние полярные связи O-H. В результате этого электростатического взаимодействия ионы натрия и хлорида разделяются, с каждым ионом окруженным чередующимися молекулами воды.
Также компоненты натрия хлорида могут реагировать с другими соединениями, образуя различные соли.
К примеру, реакция натрия хлорида с серной кислотой (H2SO4) приводит к образованию натрия сульфата (Na2SO4).
| Реакция | Уравнение реакции |
|---|---|
| Реакция натрия хлорида с серной кислотой | 2NaCl(aq) + H2SO4(aq) → Na2SO4(aq) + 2HCl(aq) |
Такие реакции с образованием солей имеют большое практическое значение и являются основой многих процессов в химической промышленности и жизни в целом. Соли, полученные из таких реакций, находят применение в различных отраслях, включая пищевую промышленность, медицину и сельское хозяйство.
Воздействие на органические вещества
Кроме того, натрий хлорид может вступать в реакции со многими органическими соединениями. Например, он может образовывать аддукты с некоторыми соединениями, что приводит к изменению их свойств и характеристик.
Один из наиболее известных примеров воздействия натрия хлорида на органические вещества — это его реакция с жирами. В результате такой реакции образуются мыльные основания, которые широко применяются в бытовых и промышленных целях.
Натрий хлорид также может использоваться в качестве катализатора в различных органических реакциях. Он способен активировать многие реакции, ускоряя их протекание и повышая выход продукта.
| Воздействие на органические вещества | Свойства |
|---|---|
| Хороший растворитель для органических соединений | Образует аддукты с некоторыми соединениями |
| Реакция с жирами, образование мыльных оснований | Используется в качестве катализатора в органических реакциях |
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Применение натрия хлорида в медицине
Натрий хлорид (NaCl), или поваренная соль, широко используется в медицине благодаря своим полезным свойствам. Внедрение растворов натрия хлорида в медицинскую практику происходило еще в XIX веке и с тех пор они стали одними из самых распространенных и эффективных обезболивающих и регидраторных средств.
Натрий хлорид широко используется при проведении внутривенных инфузий, в том числе для восстановления потерянного организмом водного и электролитного баланса. Также он используется для промывания и очищения ран, контузий и ожогов, так как помогает улучшить процесс заживления и предотвращает развитие инфекционного процесса.
На основе натрия хлорида производятся препараты для лечения таких заболеваний, как отеки, гипертоническая болезнь, заболевания почек, пищеварительной системы и др. Кроме того, натрий хлорид активно применяется в качестве средства для ингаляций при заболеваниях дыхательных путей.
| Применение натрия хлорида в медицине: |
|---|
| Внутривенные инфузии для восстановления водно-электролитного баланса |
| Промывание и очищение ран и ожогов |
| Лечение отеков, гипертонической болезни и заболеваний почек |
| Ингаляции при заболеваниях дыхательных путей |
Натрий хлорид является безопасным и доступным средством, которое эффективно применяется в медицине. Важно помнить, что все медицинские процедуры, связанные с использованием натрия хлорида, должны проводиться под наблюдением квалифицированного специалиста.
Роль в регуляции водно-солевого равновесия
Натрий хлорид также является ключевым компонентом плазмы крови, которая отвечает за транспорт питательных веществ, гормонов и других важных веществ по всему организму. Плазма крови также играет важную роль в поддержании артериального давления и участвует в регуляции объема крови.
Одной из важных функций натрия хлорида является поддержание правильного уровня гидратации организма. Он обладает способностью удерживать воду в клетках, что способствует поддержанию гомеостаза внутриклеточной среды. Также натрий хлорид регулирует уровень образования и выделения мочи, что помогает организму избавляться от лишней воды или, наоборот, сохранять ее при необходимости.
Кроме того, натрий хлорид играет важную роль в поддержании кислотно-щелочного баланса организма. Он участвует в регуляции уровня pH крови и других телесных жидкостей. Кислотно-щелочной баланс имеет важное значение для нормального функционирования органов и систем организма.
В целом, натрий хлорид является неотъемлемой частью водно-солевого равновесия, выполняя важные функции регуляции электролитного баланса и поддержания оптимальной гидратации организма. Регулирование этих процессов является необходимым для поддержания здоровья и нормального функционирования организма.
Использование в инфузионной терапии
Натрий хлорид (NaCl), также известный как столовая соль, широко используется в инфузионной терапии, где он играет важную роль в поддержании электролитного баланса и гидратации пациентов.
Один из основных компонентов растворов для инфузий, натрий хлорид обладает свойствами, способствующими восстановлению оптимального уровня электролитов в организме. Когда электролитный баланс нарушается из-за потери жидкости через пот, рвоту или диарею, инфузия с раствором натрия хлорида может помочь восстановить нормальное состояние.
Во время инфузии натрий хлорид усваивается организмом и распределяется по жидкостным отделам, восполняя дефицит физиологической жидкости. Это помогает восстановить общий объем крови и поддерживает адекватное кровообращение.
Кроме того, натрий хлорид является компонентом универсальных растворов, которые используются для растворения и/или разведения других лекарственных препаратов перед исполнением интервенционных процедур, например, инъекций или переливания крови.
Использование натрия хлорида в инфузионной терапии может быть назначено врачом при различных медицинских состояниях, таких как обезвоживание, электролитные нарушения, гиповолемия, гипернатриемия и другие. Однако, необходима индивидуальная оценка каждого пациента и коррекция дозировки в соответствии с его потребностями и состоянием здоровья.
Использование натрия хлорида в инфузионной терапии играет важную роль в поддержании здоровья пациентов, обеспечивая необходимые электролиты и восстанавливая оптимальный уровень жидкости в организме.
Видео:электролиз хлорида натрияСкачать
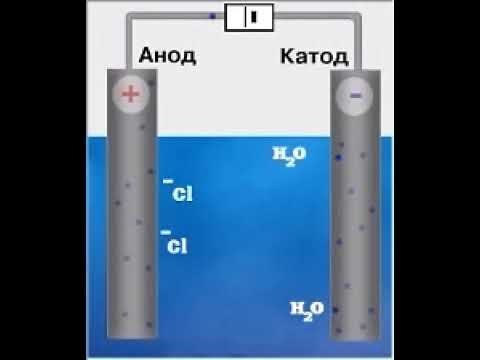
Применение натрия хлорида в пищевой промышленности
Соль используется в различных процессах пищевой обработки, таких как консервирование, маринование и соление. Она способна увеличивать срок годности пищевых продуктов, предотвращая развитие бактерий и плесневых грибков.
Кроме того, натрий хлорид обладает способностью улучшать вкус продуктов питания. Он может подчеркнуть и интенсифицировать вкусовые ощущения, делая блюда более аппетитными и приятными для потребителей.
Соль также используется в процессе выпечки. Она способствует активации дрожжей и регулирует ферментативные процессы, что влияет на структуру и текстуру хлебобулочных изделий.
Однако, несмотря на все преимущества использования натрия хлорида, его употребление следует обращать с осторожностью. Слишком большое потребление соли может негативно сказаться на здоровье, особенно на сердечно-сосудистую систему. Поэтому важно контролировать уровень потребления соли и предпочитать продукты с пониженным содержанием натрия.
Как консервант и антисептик
Натрий хлорид, или поваренная соль, широко используется в пищевой промышленности в качестве консерванта. Его присутствие в пищевых продуктах помогает предотвратить развитие микроорганизмов, таких как бактерии и плесень, что увеличивает срок их сохранности.
Натрий хлорид также обладает антисептическими свойствами и применяется для обработки ран и язв. Он способен уничтожать бактерии и предотвращать их размножение, благодаря чему способствует заживлению.
В медицине натрий хлорид также используется для профилактики и лечения некоторых заболеваний и состояний, связанных с недостатком электролитов. Кроме того, он широко применяется для приготовления физиологических растворов, используемых во время операций и в интенсивной терапии.
Использование натрия хлорида в качестве консерванта и антисептика имеет свои преимущества и ограничения, и его дозировка должна быть контролируемой. Но благодаря своим свойствам и безопасности, он является одним из наиболее распространенных и полезных соединений в пищевой и медицинской отраслях.
Добавление в пищевые продукты и приправы
Натрий хлорид, также известный как поваренная соль, широко используется в пищевой промышленности для придания вкуса и улучшения консистенции пищевых продуктов. Он добавляется в различные продукты, включая супы, соусы, маринады, мясные изделия, консервы, хлебобулочные изделия и многое другое.
Соль является одной из самых распространенных приправ, и ее присутствие может значительно повысить вкус и аромат блюда. Она также может усилить вкус других ингредиентов и помочь в достижении оптимального баланса вкусовых ощущений.
Однако добавление слишком большого количества соли в пищу может привести к негативным последствиям для здоровья, таким как повышенное артериальное давление и риск развития сердечно-сосудистых заболеваний. Поэтому важно умеренно использовать соль и следить за ее потреблением.
Помимо своего применения в качестве приправы, соль также используется в пищевой промышленности в качестве консерванта для продления срока годности продуктов. Она помогает предотвратить рост бактерий и микроорганизмов, которые могут вызывать порчу продуктов.
| Продукты, в которые добавляется соль: | Примеры блюд и продуктов, использующих соль в качестве приправы: |
|---|---|
| Супы и бульоны | Рассольники, гороховый суп, грибной суп |
| Соусы и маринады | Соевый соус, терияки, барбекю-соус |
| Мясные изделия | Колбасы, ветчина, сосиски |
| Консервы | Маринованные огурцы, помидоры, грибы |
| Хлебобулочные изделия | Хлеб, булки, пицца |
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Применение натрия хлорида в промышленности
Одним из основных применений натрия хлорида в промышленности является его использование в процессе производства хлора и щавелевой кислоты. Натрий хлорид является сырьем для электролиза, который позволяет получать газообразный хлор и растворенную соль. Хлор используется в производстве пластиков, лакокрасочных материалов, удобрений, а также водопроводной обработке.
Кроме того, натрий хлорид также используется в записи и предохранении пищевых продуктов. Он является незаменимым компонентом при солении и консервировании овощей, рыбы, мяса и других продуктов. Натрий хлорид также используется в пищевой промышленности для регулирования вкусовых качеств и консервации пищевых продуктов.
Кроме того, натрий хлорид применяется в производстве стекла. Он способствует снижению температуры плавления и повышению прозрачности стекла. Благодаря добавлению натрия хлорида, стекло становится более прочным, устойчивым к воздействию влаги и кислот.
Натрий хлорид также применяется в нефтегазовой промышленности. Он используется для бурения скважин, обработки нефтяных и газовых скважин, а также для изготовления буровых растворов. Натрий хлорид способствует поддержанию устойчивости явлений в течении бурения и снижению трения в процессе обработки скважин.
В целом, натрий хлорид играет важную роль в промышленности благодаря своим уникальным свойствам и многообразию применений. Он является неотъемлемой частью процессов производства и использования различных товаров и продуктов, находя применение в различных сферах деятельности.
Применение в производстве химических веществ
Натрий хлорид, или обычная кухонная соль, широко используется в промышленности для производства различных химических веществ. Его уникальные свойства и доступность делают его незаменимым компонентом во многих процессах.
Одним из основных применений натрия хлорида является производство хлора и каустической соды, или натряной щелочи. Хлор используется в производстве пластмасс, резиновых изделий, протравливании тканей, очистке воды и других процессах. Каустическая сода используется в текстильной, бумажной и металлургической промышленности, а также в производстве стекла и моющих средств.
Натиевые реагенты, получаемые из натрия хлорида, широко используются в химических разработках и исследованиях. Они играют важную роль в синтезе органических соединений и процессах выделения и анализа химических веществ.
Натрий хлорид является также основным компонентом при производстве гипохлорита натрия, который широко применяется в качестве отбеливателя, дезинфицирующего средства и окислителя в различных отраслях промышленности, включая пищевую, медицинскую и бытовую сферы.
Кроме того, натрий хлорид используется для создания электролитических растворов, которые используются в электрохимических процессах, таких как гальванизация и электролиз.
Применение натрия хлорида в производстве химических веществ разнообразно и обширно. Его уникальные свойства и доступность делают его незаменимым компонентом во многих отраслях промышленности.
📽️ Видео
Простое очищение организма Вывод токсинов Тиосульфат натрия Ответы на вопросыСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

10 неожиданных применений хлоргексидина, о которых не пишут в инструкцииСкачать

Получение хлората калия, бертолетовой соли из отбеливателя (химия)Скачать

ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Опыты по химии. Получение гидроксида железа (III) и изучение его свойствСкачать

Пожилой врач посоветовал 3 капли хлоргексидина... Вот от чего Хлоргексидин!Скачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Натрия тиосульфат. Детокс. Очищение организма мой личный опыт.Скачать

17. Зачем с лекарством вводят физраствор?Скачать

СОЛЬ - Хлорид натрия - NaCl - Польза и вред для организма человекаСкачать
