Атом — это основная единица материи, которая состоит из трех основных компонентов: электронов, протонов и нейтронов. Эти частицы называются элементарными частицами, так как они являются фундаментальными составляющими в химии и физике. Понимание структуры атома является ключевым для понимания основ химических реакций и взаимодействия различных элементов в природе.
Первым компонентом атома является электрон — негативно заряженная частица, которая обращается по орбитам вокруг ядра атома. Орбиты электронов называют энергетическими уровнями или электронными оболочками. Количество электронов на каждом энергетическом уровне определяется номером атома в периодической системе Менделеева. Электроны имеют отрицательный заряд и образуют зону возле ядра, где происходят основные химические реакции.
Вторым компонентом атома является протон — положительно заряженная частица, находящаяся в ядре атома. Количество протонов определяет номер элемента в периодической системе Менделеева. Точное количество протонов в ядре называется атомным номером и определяет его химические свойства. Протоны имеют положительный заряд и взаимодействуют с электронами при химических реакциях.
Третьим компонентом атома является нейтрон — бесполый нейтральный элементарный частица, находящаяся в ядре вместе с протонами. Нейтроны не имеют заряда и взаимодействуют с протонами внутри ядра. Их главная роль заключается в поддержании стабильности атома и предотвращении рассеивания протонов под воздействием электростатических сил.
- Атом как основная единица материи
- Выполнение своей функции
- Изучение атомов в химии
- Важность понимания структуры атома
- Влияние атомов на свойства веществ
- Структурные составляющие атома
- Электроны как основные компоненты атома
- Протоны и их влияние на заряд атома
- Нейтроны и их роль в стабильности атома
- Внутренняя структура атома
- Область пространства, занимаемая электронами
- Ядро атома и его компоненты
- Связь между электронами и ядром атома
- Шеллы и энергетические уровни
- Расположение электронов на энергетических уровнях
- Основные энергетические уровни и их значимость
- Корпускулярно-волновой дуализм электронов в шеллах
- Ионизация и заряд атома
- Образование ионов и их заряды
- Зависимость заряда иона от числа электронов и протонов
- Роль ионов в химических реакциях
- 🔍 Видео
Видео:8 класс. Распределение электронов в атоме. Электронные формулы.Скачать

Атом как основная единица материи
Ядро — это центральная часть атома, состоящая из протонов и нейтронов. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Ядро содержит почти всю массу атома, а также определяет его химические свойства.
Электронная оболочка — это область вокруг ядра, где находятся электроны. Электроны имеют отрицательный заряд и движутся по орбитам вокруг ядра. Электроны образуют электронные облака, которые определяют распределение электронной плотности и химические свойства атома.
Электроны — это невесомые частицы, которые находятся в постоянном движении вокруг ядра. Количество электронов в атоме равно количеству протонов в ядре, что делает атом электрически нейтральным. Электроны также отвечают за химическую активность атома и его способность вступать в химические реакции.
Таким образом, атом является базовой единицей материи, из которой состоят все вещества в нашей вселенной. Понимание структуры атома позволяет увидеть основу химических элементов и понять разнообразие химических реакций и свойств вещества.
Видео:СТРОЕНИЕ АТОМА ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Выполнение своей функции
Электроны – отрицательно заряженные частицы, которые вращаются вокруг ядра атома по определенным энергетическим уровням. Они участвуют в химических реакциях, создавая связи с другими атомами.
Протоны – положительно заряженные частицы, которые находятся в ядре атома. Количество протонов определяет химические свойства элемента.
Нейтроны – нейтральные частицы, которые также находятся в ядре атома. Они имеют массу, но не имеют заряда.
Все эти компоненты атома работают вместе, чтобы обеспечить его функционирование. Электроны образуют электронные облака, которые определяют химические связи и возможность реакций. Протоны создают положительный заряд ядра, а нейтроны помогают поддерживать стабильность и массу атома.
Важно отметить, что каждый атом имеет уникальное количество электронов, протонов и нейтронов, что определяет его химические и физические свойства.
Изучение атомов в химии
Для изучения атомов химики используют различные методы и инструменты. Одним из основных методов является спектроскопия, которая позволяет анализировать взаимодействие света с атомами и молекулами. С помощью спектроскопии можно определить энергетические уровни и спектральные линии атомов, что позволяет получить информацию о структуре и свойствах атомов.
Еще одним важным методом изучения атомов является рентгеноструктурный анализ, который позволяет определить трехмерную структуру атомов и молекул в кристаллах. С помощью рентгеноструктурного анализа можно получить информацию о расположении атомов в пространстве и о связях между ними.
Нанотехнологии также играют важную роль в изучении атомов. С помощью методов нанофабрикации химики могут создавать и манипулировать отдельными атомами, что позволяет исследовать их свойства и поведение на микроскопическом уровне.
| Метод | Описание |
|---|---|
| Спектроскопия | Изучение взаимодействия света с атомами и молекулами для определения их свойств и структуры. |
| Рентгеноструктурный анализ | Определение трехмерной структуры атомов и молекул с помощью рентгеновского излучения. |
| Нанотехнологии | Создание и манипулирование отдельными атомами для исследования их свойств и поведения. |
В совокупности эти методы позволяют углубленно изучать атомы, раскрывая их свойства и строение. Изучение атомов является необходимой основой для понимания химических реакций и взаимодействия веществ, что позволяет разрабатывать новые материалы, лекарственные препараты и другие продукты промышленности.
Важность понимания структуры атома
Исследование структуры атома позволяет понять, какие элементы присутствуют в веществе и как они связаны между собой. Это позволяет определить химические свойства вещества, такие как его реактивность, степень растворимости и термическая стабильность.
Понимание структуры атома также необходимо для понимания ядерных реакций и радиоактивности. Знание о том, как ядерные частицы взаимодействуют, позволяет разрабатывать способы создания и контроля ядерной энергии, а также прогнозировать и измерять радиационные уровни в окружающей среде.
Более глубокое понимание структуры атома также имеет важное значение в различных областях науки и технологии. Например, в фармацевтической индустрии изучение структуры атома помогает разрабатывать более эффективные лекарства, а в материаловедении — создавать новые материалы с уникальными свойствами.
Таким образом, понимание структуры атома является фундаментальным знанием в химии и физике, которое помогает расширить наше понимание мира и использовать его в практических приложениях.
Влияние атомов на свойства веществ
Различные атомы имеют разное количество протонов, нейтронов и электронов, что влияет на их заряд, массу и размеры. Протоны и нейтроны сосредоточены в ядре атома, в то время как электроны находятся на орбиталях вокруг ядра.
Свойства вещества определяются его атомами и их взаимодействиями. Например, количество и расположение электронов в атоме определяет его электронную конфигурацию, которая влияет на его химическую активность и способность формировать химические связи.
Также, свойства вещества зависят от масштаба и структуры его атомов. Например, атомы металлов имеют больший размер и электронная оболочка с низкой энергией, что обуславливает их хорошую электропроводность. Атомы неметаллов, напротив, имеют малый размер и высокую энергию электронной оболочки, что делает их нетоксичными и плохо проводящими электричество.
| Атомы | Свойства |
|---|---|
| Металлы | Хорошая электропроводность |
| Неметаллы | Нетоксичность, плохая электропроводность |
Кроме того, атомы могут образовывать молекулы, которые имеют свои характеристики и свойства. Взаимодействие атомов в молекулах определяет физические и химические свойства вещества.
Таким образом, атомы играют важную роль в определении свойств вещества. Изучение структуры и свойств атомов позволяет более глубоко понять химические реакции, соединения и материалы.
Видео:БЕЗ ЭТОГО НЕ СДАТЬ ЕГЭ по Химии — Электронная конфигурация атомаСкачать

Структурные составляющие атома
Атом состоит из трех основных структурных составляющих: ядра, электронной оболочки и связей между ними.
Ядро атома представляет собой наиболее плотную и тяжелую часть атома. Оно состоит из протонов и нейтронов, которые называются нуклонами. Протоны имеют положительный заряд, в то время как нейтроны не имеют заряда. Локализованное в центре атома, ядро определяет его массу и атомный номер.
Электронная оболочка представляет собой пространство вокруг ядра, в котором движутся электроны. Электроны имеют отрицательный заряд и обладают очень малой массой по сравнению с протонами и нейтронами. Образующие оболочку электроны расположены на разных энергетических уровнях и образуют электронные облака в форме орбиталей или волновых функций.
Связи между ядром и электронной оболочкой обеспечиваются силой электростатического притяжения между положительно заряженным ядром и отрицательно заряженными электронами. Эти связи определяют стабильность атома и его химические свойства. В зависимости от числа электронов во внешней оболочке атом может проявлять различную химическую активность.
Электроны как основные компоненты атома
Количество электронов в атоме определяет его электронную конфигурацию и химические свойства. Обычно количество электронов в атоме равно количеству протонов, что делает атом электрически нейтральным. Если количество электронов не совпадает с количеством протонов, то атом становится ионом и приобретает электрический заряд.
Движение электронов вокруг ядра атома осуществляется на определенных энергетических уровнях, которые называются энергетическими оболочками. Каждая энергетическая оболочка может содержать определенное количество электронов.
Электроны находятся в различных орбиталях, которые представляют собой трехмерные области пространства, где с наибольшей вероятностью можно найти электрон. Орбитали также характеризуются формой, например, сферической или шайбовидной.
Изменение энергии электронов может происходить при взаимодействии атомов с другими атомами или с внешними факторами, такими как электрическое или магнитное поле. Это может привести к изменению электронной конфигурации атома и его химического поведения.
Протоны и их влияние на заряд атома
Каждый протон имеет заряд +1е, где е — элементарный заряд. Заряд атома определяется числом протонов в его ядре. Например, если в атоме есть 6 протонов, то заряд атома будет равен +6е, так как каждый протон имеет заряд +1е. Если в атоме есть 7 протонов, то заряд атома будет равен +7е.
Заряд протонов очень важен в химии, так как определяет химические свойства атома. Если атом имеет положительный заряд, то он называется ионом, и его свойства могут отличаться от нейтрального атома. Например, ион с положительным зарядом может образовывать ионы с отрицательным зарядом (анионы) или молекулы, вступать в химические реакции и т.д.
Определение заряда протонов позволяет нам лучше понять структуру и свойства атомов. Протоны являются основной составляющей ядра и играют важную роль в химических процессах и реакциях. Благодаря протонам, атомы могут взаимодействовать друг с другом и образовывать комплексы, соединения исходя из их зарядов и электростатического взаимодействия.
Нейтроны и их роль в стабильности атома
Нейтроны играют важную роль в стабильности атома. Это связано с их влиянием на ядро. Протоны, находящиеся в ядре, имеют положительный заряд, и электростатическое отталкивание между ними пытается разорвать ядро. Однако, нейтроны, не обладая зарядом, не взаимодействуют с протонами этим образом.
Наличие нейтронов в атомном ядре позволяет сгладить отталкивание между протонами и, таким образом, устранить возможность разрушения ядра. Чем больше нейтронов в ядре, тем стабильнее атом. Таким образом, нейтроны способствуют сохранению стабильности атома и предотвращают его распад.
Видео:Современная теория строения атома. Состояние и движение электронов в атоме. 1 часть. 10 класс.Скачать
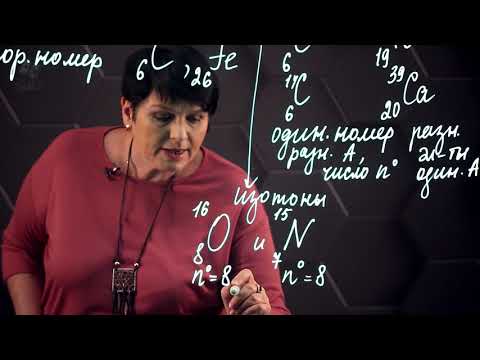
Внутренняя структура атома
Электроны — элементарные частицы с отрицательным электрическим зарядом. Они находятся вокруг ядра атома и образуют электронные оболочки. В атоме количество электронов обычно равно количеству протонов, что делает атом электрически нейтральным.
Протоны — элементарные частицы с положительным электрическим зарядом. Они находятся в ядре атома и определяют его химические свойства, так как количество протонов определяет атомный номер элемента. Например, водород имеет один протон, а углерод имеет шесть протонов.
Нейтроны — элементарные частицы без электрического заряда. Они также находятся в ядре атома и их функция — обеспечить стабильность ядра, уравновесивая притяжение протонов.
Внутренняя структура атома сложна и подробно изучается в атомной физике. Понимание этой структуры позволяет объяснить множество химических явлений и процессов.
Область пространства, занимаемая электронами
Электроны, являющиеся основными компонентами атома, занимают определенную область вокруг ядра. Эта область называется электронной оболочкой.
Электроны находятся на разных энергетических уровнях, которые называются электронными обертками или орбитами. Каждая электронная обертка может вмещать определенное количество электронов.
Внутренние электронные обертки находятся ближе к ядру и имеют более высокий энергетический уровень. Они могут вмещать меньшее количество электронов по сравнению с внешними электронными обертками.
Электроны вне внутренних электронных оберток обладают более высокой энергией и называются валентными электронами. Это электроны, которые участвуют в химических реакциях и определяют химические свойства атома.
Общее количество электронов в атоме равно количеству протонов в ядре, что обеспечивает электрическую нейтральность атома.
| Номер оболочки | Максимальное количество электронов |
|---|---|
| 1 | 2 |
| 2 | 8 |
| 3 | 18 |
| 4 | 32 |
Таким образом, распределение электронов по электронным оболочкам атома определяет его важные химические свойства и взаимодействия с другими атомами.
Ядро атома и его компоненты
Протоны и нейтроны имеют почти одинаковую массу, но различаются зарядами. Протоны имеют положительный элементарный заряд, равный +1, а нейтроны остаются электрически нейтральными.
Количество протонов в ядре определяет химический элемент, к которому относится атом. Например, атом с одним протоном в ядре является атомом водорода, атом с двумя протонами — гелия, и так далее.
Нейтроны служат для поддержания стабильности ядра атома. Они взаимодействуют с протонами и друг с другом с помощью сильных ядерных сил, которые превышают отталкивающие электрические силы между протонами.
Ядро атома в значительной степени определяет его свойства и химическое поведение. Изменение количества протонов и нейтронов в ядре может привести к образованию изотопов атомов, которые имеют разное количество нейтронов, но тот же номер протонов.
Понимание ядра атома и его компонентов является ключевым для изучения различных явлений в химии и физике, включая радиоактивность и ядерные реакции.
Связь между электронами и ядром атома
Связь между электронами и ядром атома играет важную роль в химии и физике. Она определяет структуру и свойства атомов, а также взаимодействия, которые происходят между атомами.
Ядро атома состоит из протонов и нейтронов, которые обладают положительным и нейтральным зарядом соответственно. Электроны находятся вокруг ядра атома и обладают отрицательным зарядом.
Силой притяжения между положительно заряженным ядром и отрицательно заряженными электронами является электрическая сила. Эта сила позволяет электронам оставаться в орбиталях или энергетических уровнях вокруг ядра.
Связь между электронами и ядром атома определяется тремя основными характеристиками: электрической силой притяжения, массой электрона и массой ядра.
Чтобы атом был стабилен, электрическая сила притяжения между электронами и ядром должна быть равновесной с центробежной силой, действующей на электроны из-за их вращения вокруг ядра. Это равновесие обеспечивает существование орбиталей и энергетических уровней.
Масса электрона существенно меньше массы ядра атома, поэтому электроны могут двигаться быстро вокруг ядра и создавать облако электронной плотности. Электроны на разных энергетических уровнях обладают различной энергией и характеризуются различными квантовыми числами.
Связь между электронами и ядром атома играет ключевую роль в химических реакциях и взаимодействиях атомов. Она определяет структуру молекул и их химические свойства. Понимание этой связи позволяет разрабатывать новые материалы и прогнозировать химическую активность различных соединений.
Видео:Характеристика элемента по положению в Периодической системе и строению атома. 1 часть. 8 класс.Скачать

Шеллы и энергетические уровни
Внутренними шеллами называются шеллы, которые находятся ближе всего к ядру, а внешними шеллами являются шеллы, находящиеся дальше от ядра. Каждый шелл имеет определенную энергию, а энергетические уровни внутри шеллов также различаются.
Энергетические уровни представляют собой различные энергии электронов на каждом шелле. Они обозначаются числами 1, 2, 3 и т.д., где число 1 соответствует самому ближнему к ядру шеллу. Каждый шелл имеет ограниченное количество электронов, которое определяется по формуле 2n^2, где n — номер шелла. Например, на первом шелле может находиться до 2 электронов, на втором – до 8 и т.д.
Энергетические уровни внутри каждого шелла также имеют свои отметки. Чем выше энергетический уровень, тем дальше он находится от ядра атома. Электроны на более высоких уровнях имеют большую потенциальную энергию и могут быть легче отрываться от атома.
Взаимодействие между электронами в различных шеллах и энергетические переходы между уровнями определяют многие свойства и реакции в химии. Понимание разделения шеллов и энергетических уровней помогает объяснить наличие химической активности и стабильности различных элементов.
Расположение электронов на энергетических уровнях
Атом состоит из ядра, в котором находятся протоны и нейтроны, и облака электронов, которое занимает пространство вокруг ядра. Электроны в атоме находятся на энергетических уровнях, которые определяются их энергией.
Первый энергетический уровень, ближайший к ядру, обозначается как 1s и может вместить максимум 2 электрона. Второй энергетический уровень обозначается как 2s и также может содержать не более 2 электронов. Дополнительно второй уровень имеет подуровни, такие как 2p, которые могут вместить максимум 6 электронов (по 2 на каждый подуровень).
Третий и последующие энергетические уровни также имеют s, p и d подуровни, которые могут содержать 2, 6 и 10 электронов соответственно. Четвертый уровень, например, имеет подуровни 4s, 4p и 4d.
Расположение электронов на энергетических уровнях подчиняется принципам заполнения электронных оболочек, таким как принцип минимальной энергии и принцип полного заполнения. Эти принципы определяют порядок расположения электронов и позволяют предсказать структуру атома и его свойства.
Распределение электронов на энергетических уровнях в атоме определяет его химическую активность и возможность образования химических связей с другими атомами. Количество электронов на внешнем энергетическом уровне также определяет валентность атома и его способность к образованию химических соединений.
Основные энергетические уровни и их значимость
Существует несколько основных энергетических уровней в атоме, обозначаемых буквами K, L, M и т.д. Уровень K является самым близким к ядру и имеет наименьшую энергию, в то время как уровень M находится дальше от ядра и имеет более высокую энергию.
Энергетические уровни определяют поведение электронов в атоме и их возможность образования химических связей. Наиболее стабильный и низкоэнергетический электронный уровень называется электронной оболочкой. На этом уровне находятся основные электроны атома.
Значимость энергетических уровней состоит в следующем:
- Они определяют электронную конфигурацию атома и его химические свойства.
- Энергетические уровни позволяют объяснить явления, такие как испускание и поглощение энергии электронами.
- Они играют важную роль в объяснении переходов между энергетическими состояниями атома, что позволяет понять спектральные линии в спектроскопии.
- Понимание энергетических уровней помогает установить основные принципы химической связи в молекулах и соединениях.
Таким образом, основные энергетические уровни являются ключевыми компонентами атома, определяющими его свойства и поведение в химических реакциях. Изучение этих уровней позволяет получить глубокое понимание структуры и функций атомов в химической науке.
Корпускулярно-волновой дуализм электронов в шеллах
В электронах, населяющих электронные оболочки атомов, также проявляется корпускулярно-волновой дуализм. Это означает, что электрон можно представить как частицу, однако в определенных ситуациях его поведение может быть описано волновыми понятиями.
Наиболее ярким проявлением этого волнового свойства является распределение электронной плотности вокруг атомного ядра. В электронной оболочке атома электрон находится не в определенной точке, а занимает область пространства, которая называется шеллом. Шелл представляет собой объем, в котором существует наибольшая вероятность обнаружить электрон.
Каждый шелл состоит из набора подуровней, которые имеют различную форму и энергию. Подуровни обладают различной объемной плотностью вероятности нахождения электрона в пространстве.
Однако важно отметить, что электрон не движется по строго определенной орбите, как это было представлено в старой модели Бора, а находится в состоянии постоянного движения и изменения своего положения. Это объясняется волновым свойством электрона и принципом неопределенности Гейзенберга.
Таким образом, корпускулярно-волновой дуализм электронов в шеллах является одним из ключевых понятий в квантовой физике и химии. Он позволяет более глубоко понять и объяснить поведение электронов в атомах, а также является основой для развития многих квантово-механических моделей атома.
Видео:ХИМИЯ строение атома и СТРОЕНИЕ ЭЛЕКТРОННЫХ ОБОЛОЧЕК атомов 8 классСкачать

Ионизация и заряд атома
Атомы, как правило, имеют неполный набор электронов в своих электронных оболочках, что делает их электрически нейтральными. Однако атомы способны претерпевать процесс ионизации, при котором один или несколько электронов могут быть удалены из атома или добавлены к нему.
Ионизация может произойти под воздействием внешних факторов, таких как тепло, свет или электрический ток. В результате ионизации атом образует ион, который может быть положительно или отрицательно заряженным в зависимости от того, потерял или приобрел он электроны.
Когда атом теряет электрон и становится положительно заряженным, он превращается в положительный ион, который называется катионом. Например, водородный атом (H) может потерять свой единственный электрон и превратиться в положительный ион H+. Атомы металлов, такие как натрий (Na) или железо (Fe), также могут образовывать катионы, потеряв один или несколько электронов.
С другой стороны, когда атом получает электрон и становится отрицательно заряженным, он превращается в отрицательный ион, который называется анионом. Примером аниона может служить хлоридный ион (Cl-), который образуется, когда атом хлора (Cl) получает один электрон.
Заряд атома, как ионизация, играет важную роль в химических реакциях. Заряженные атомы и ионы могут образовывать сильные электростатические связи с другими атомами или ионами и участвовать в обмене электронами, что позволяет происходить химическим реакциям и образованию новых веществ.
Образование ионов и их заряды
В химии ионы играют важную роль, представляя собой заряженные атомы или группы атомов. Ионы могут быть положительно заряженными (катионами) или отрицательно заряженными (анионами), в зависимости от того, потеряют или приобретут атомы электроны. Образование ионов происходит в результате химических реакций.
Когда атом потеряет электроны, он превращается в положительно заряженный катион. Катионы образуются, когда атомы металлов отдают один или несколько электронов, чтобы достичь стабильной электронной конфигурации. Заряд катиона указывает, сколько электронов атом отдал. Например, катион натрия Na+ образуется, когда натрий отдает один электрон.
Анионы образуются, когда атомы не металлов получают электроны, чтобы достичь стабильной электронной конфигурации. Анионы обладают отрицательным зарядом. Заряд аниона указывает, сколько электронов атом получил. Например, анион хлора Cl- образуется, когда атом хлора получает один электрон.
Знание заряда ионов помогает определить химические свойства веществ и предсказать, какие химические реакции могут произойти. Заряд ионов также используется для построения химических формул и уравнивания уравнений реакций.
| Элемент | Ион | Заряд |
|---|---|---|
| Калий | K+ | 1 |
| Магний | Mg2+ | 2 |
| Хлор | Cl- | -1 |
Зависимость заряда иона от числа электронов и протонов
Заряд иона, который представляет собой атом или группу атомов с недостатком или избытком электронов, зависит от разности между числом протонов и электронов в атоме. Заряд иона может быть положительным, отрицательным или нейтральным.
Если число протонов в атоме превышает число электронов, то ион будет иметь положительный заряд. Каждый протон несет единичный положительный заряд, поэтому количество протонов определяет величину положительного заряда иона. Например, если в атоме находится 10 протонов и 8 электронов, то ион будет иметь заряд +2.
Если число электронов превышает число протонов в атоме, то ион будет иметь отрицательный заряд. Каждый электрон несет единичный отрицательный заряд, поэтому количество электронов определяет величину отрицательного заряда иона. Например, если в атоме находится 8 протонов и 10 электронов, то ион будет иметь заряд -2.
Если число протонов и электронов совпадает, то ион будет нейтральным и не будет иметь заряда. Например, если в атоме находится 10 протонов и 10 электронов, то ион будет нейтральным.
Ионная зарядность играет важную роль в химических реакциях и взаимодействии различных веществ. Знание зависимости заряда иона от числа электронов и протонов помогает в понимании структуры атомов и молекул, а также в объяснении и предсказании химических свойств веществ.
Роль ионов в химических реакциях
Во время химической реакции ионы могут образовывать новые соединения, а также разлагаться на отдельные атомы или молекулы. Ионы могут быть включены в структуру реагирующих веществ или являться продуктами реакции.
Ионы способны притягиваться друг к другу или отталкиваться в зависимости от знака их зарядов. Заряд притягивает противоположные заряды и отталкивает одинаковые. Это явление называется электростатической силой.
Результатом взаимодействия ионов в химических реакциях могут быть образование новых химических соединений, изменение свойств вещества, образование осадка или изменение цвета реакционной смеси.
Ионы также способны проводить электрический ток, что делает их важными для электрохимических реакций и использования в различных электрических устройствах.
🔍 Видео
Состав и строение атома. Изотопы. 7 класс.Скачать

Строение атома. Как составить электронную и электронно-графическую формулы?Скачать

Как перейти порог на ЕГЭ по химииСкачать

Строение атома, электронные конфигурации | Химия ЕГЭ для 10 класса | УмскулСкачать

Из чего состоит атом? Просто о сложном.Скачать

Лучшая модель атома? [Минутка физики]Скачать
![Лучшая модель атома? [Минутка физики]](https://i.ytimg.com/vi/eybcxXiYJfc/0.jpg)
8 класс. Строение атома.Скачать
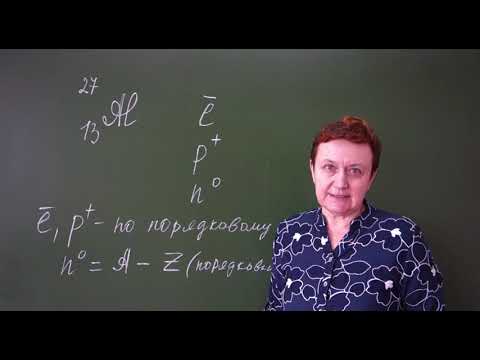
Квантовые числа. 1 часть. 10 класс.Скачать

Электронные конфигурации атомов. Химия – простоСкачать

Строение атома | Химия ЦТ, ЕГЭСкачать

СТАРТ КУРСА «ХимФак 2023» | 1 урок | Строение атома | Екатерина Строганова | 100балльный репетиторСкачать

ХИМИЯ ПРОСТО — Электронная конфигурация атомаСкачать

Периодический Закон | ПСХЭ | Таблица Менделеева [Урок 9]Скачать
![Периодический Закон | ПСХЭ | Таблица Менделеева [Урок 9]](https://i.ytimg.com/vi/oFBqizueCd4/0.jpg)
ВСЯ ХИМИЯ С НУЛЯ! | Денис Марков | УмскулСкачать
