Углерод – один из самых распространенных элементов в природе, оказывающий огромное влияние на все живые организмы и на саму Землю. Он считается основой жизни, так как является основным строительным компонентом органических соединений.
Атомы углерода обладают уникальными свойствами, позволяющими им образовывать огромное количество различных соединений. Углерод способен соединяться с другими атомами углерода и другими элементами, что делает его основой для образования разнообразных органических соединений, включая углеводороды, жиры, белки и нуклеиновые кислоты.
Основные формы углерода – графит и алмаз – имеют разные структуры и свойства. Графит представляет собой слоистую структуру, где атомы углерода расположены в виде плоскости гексагональных колец. Эта структура придает графиту мягкость и смазочные свойства. В свою очередь, алмаз имеет трехмерную кристаллическую структуру, где атомы углерода связаны в сильные ковалентные связи. Именно благодаря такому строению алмаз обладает высокой твердостью и является самым твердым известным материалом.
Видео:Химия. 9 класс (Урок№17 - Углерод. Аллотропные модификации углерода.Химические свойства. Адсорбция.)Скачать

Основные компоненты углерода
Органические соединения — одна из основных форм углерода. В них углерод атомы связываются с другими атомами углерода и атомами других элементов, образуя сложные структуры. Примерами органических соединений являются углеводороды, белки, жиры и нуклеиновые кислоты.
Неметаллический аллотропный углерод — еще одна форма углерода. Эти аллотропы, такие как алмаз, графит и фуллерены, имеют различные структуры и свойства. Алмаз является твердым и прозрачным за счет его трехмерной кристаллической структуры, графит обладает слоистой структурой и используется в качестве смазки, а фуллерены имеют форму полых сферических молекул.
Углерод также может образовывать комплексы со многими другими элементами, такими как водород, кислород, азот и металлы. Эти комплексы могут иметь различные структуры и свойства, и широко применяются в различных областях науки и технологий.
В целом, основные компоненты углерода представляют собой органические соединения, неметаллические аллотропы и комплексы с другими элементами. Это делает углерод одним из самых важных и универсальных элементов в природе.
| Форма углерода | Свойства и примеры |
|---|---|
| Органические соединения | Углеводороды, белки, жиры, нуклеиновые кислоты |
| Алмаз | Твердый, прозрачный, сложная трехмерная структура |
| Графит | Слоистая структура, используется в смазках и карандашах |
| Фуллерены | Полые сферические молекулы, широко применяются в нанотехнологиях |
| Комплексы с другими элементами | Многообразные структуры, широко используются в науке и технологиях |
Видео:Углерод - Самый СТРАННЫЙ химический Элемент!Скачать

Органический углерод
Углерод имеет способность образовывать длинные цепи и кольца, а также связываться с другими атомами, в основном с атомами водорода, кислорода, азота и фосфора. Это позволяет углероду образовывать разнообразные химические связи и создавать сложные молекулы.
Углеродные соединения играют важную роль в живой природе. Они являются основными компонентами биологических молекул, таких как ДНК и РНК, которые определяют генетическую информацию живых организмов. Органические соединения также участвуют в обмене веществ и энергии, обеспечивая поддержание жизнедеятельности организмов.
В природе органический углерод может находиться в различных формах. Один из его наиболее распространенных видов — это органическое вещество в почве. Оно представлено остатками растительного и животного происхождения, которые подвергаются разложению при участии организмов — детритофагов и микроорганизмов.
Органический углерод также встречается в горных породах, например в углях и нефти, которые являются источниками энергии, используемыми человеком. Благодаря углероду были созданы различные материалы и вещества, такие как пластик, резина, текстильные волокна и прочие, которые широко используются в различных отраслях промышленности.
Таким образом, органический углерод является основным строительным блоком жизни на Земле, обладая уникальной способностью образовывать разнообразные соединения и играя важную роль в живой природе и промышленности.
Насыщенный углерод
Одним из наиболее известных примеров насыщенного углерода является алмаз — самый твердый минерал, состоящий исключительно из углерода. В алмазе каждый атом углерода образует четыре ковалентные связи с другими атомами углерода, образуя кристаллическую решетку.
Также насыщенные углеродные соединения играют важную роль в органической химии. Например, насыщенные углеводороды, такие как метан и этан, являются основными компонентами природного газа и нефти.
Важно отметить, что насыщенный углерод отличается от несищенного (пиридина) углерода, в котором атомы углерода образуют по три связи с другими атомами.
Ненасыщенный углерод
Ненасыщенный углерод является основным компонентом органических соединений, таких как алкены и алкины. В алкенах углеродные атомы связаны двойными связями, а в алкинах — тройными связями. Эти соединения обладают высокой активностью и реакционной способностью.
Под действием различных реагентов ненасыщенный углерод может подвергаться аддиционным реакциям, при которых к двойной или тройной связи добавляется атом или группа атомов. Также возможны реакции окисления ненасыщенного углерода, которые приводят к образованию карбонильных групп.
| Название соединения | Структурная формула | Примеры |
|---|---|---|
| Алкены | Этен (этилен), пропен (пропилен) | |
| Алкины | Пропин (пропинат), бутин (бутилен) |
Ненасыщенный углерод широко применяется в органической химии, фармацевтической промышленности и производстве пластиков. Он также играет важную роль в биохимии и является основой для построения разнообразных органических соединений.
Таким образом, ненасыщенный углерод является важным компонентом, который обладает высокой химической активностью и находит широкое применение в различных областях науки и промышленности.
Видео:Фазы в сплавах "железо-углерод" | Матвед 3Скачать

Неорганический углерод
Одним из самых распространенных неорганических форм углерода является графит. Он обладает слоистой структурой и является плохим проводником электричества. Графит широко используется в различных отраслях, включая производство карандашей, водяных красок и теплоэлектрических изделий.
Другой формой неорганического углерода является алмаз. Алмаз – один из самых твердых материалов на Земле и имеет кристаллическую структуру. Он широко используется в ювелирной промышленности и в производстве режущих инструментов.
Аморфный углерод – это неорганическая форма углерода, которая не имеет определенной кристаллической структуры. Эта форма углерода может иметь различные свойства в зависимости от способа ее получения. Аморфный углерод применяется в производстве электродов, адсорбентов и других промышленных продуктов.
Алмазы
Алмазы представляют собой особый вид углерода, являющийся самым твердым известным материалом на Земле. Они обладают высокой прочностью, твердостью и термической стабильностью.
Алмазы образуются в глубинах Земли под действием высокого давления и температуры. Они могут быть добыты из кимберлитовых и лампорфировых трубок, которые возникают в результате вулканической активности. Основной район добычи алмазов находится в Африке, в странах таких как Ботсвана, Южная Африка и Зимбабве.
Алмазы применяются в различных отраслях, таких как ювелирное дело, производство инструментов и электроника. Они используются для изготовления драгоценных украшений, а также для создания режущих и точных инструментов, таких как буры и ножи. Благодаря своей термической стабильности, алмазы также используются в высокотехнологичных отраслях, например, для создания полупроводниковых материалов и лазеров.
Алмазы могут иметь различные цвета, от прозрачного и бесцветного до разнообразных оттенков, включая желтый, розовый, синий и зеленый. Цвет алмаза зависит от примесей, включенных в его структуру. Чистые и бездекоративные алмазы, так называемые «фантазийные» алмазы, являются наиболее ценными и дорогими.
Алмазы имеют большую оптическую преломляющую способность и отличаются блеском, известным как алмазный блеск. Они также хорошо проводят тепло и электричество.
Алмазы являются уникальными и прекрасными кристаллами, которые восхищают людей своей красотой и ценностью на протяжении многих веков.
Графит
Графит имеет слоистую структуру, которая обеспечивает ему ряд уникальных характеристик. Каждый слой графита состоит из атомов углерода, которые соединены друг с другом в виде шестиугольников, образуя плоскую гексагональную решетку. Эти слои упорядочены параллельно друг другу и легко сдвигаются друг относительно друга. Благодаря этому свойству графит обладает мягкостью и смазывающими свойствами.
Однако наружные слои графита плотно связаны друг с другом, поэтому графит обладает достаточной прочностью и жесткостью. В результате этих свойств графит является идеальным материалом для создания графитовых стержней, которые используются в механических карандашах.
Графит также обладает высокой теплопроводностью и электропроводностью. Это делает его незаменимым материалом в производстве электродов для арочной сварки, электролизных процессов и других технических приложений.
Видео:Классификация углеродистых сталей | Матвед 4Скачать
Состав углерода
Основная форма углерода — аллотропная форма, известная как графит. Графит представляет собой слоистый материал, состоящий из плоских слоев атомов углерода, связанных сильными ковалентными связями внутри слоя, но слабо взаимодействующих смежными слоями. Это делает графит мягким и смазочным материалом.
Ещё одна форма углерода — аллотропная, называемая алмаз. Алмаз представляет собой кристаллическую решетку, в которой каждый атом углерода образует ковалентные связи с 4 соседними атомами. Это делает алмаз одним из самых твёрдых материалов на земле.
Углерод также может образовывать множество других соединений, включая углеводороды, аминокислоты и нуклеотиды, основные строительные блоки жизни. Благодаря своей способности образовывать разнообразные связи, углерод имеет огромное значение в органической химии и биологии.
🎬 Видео
Углерод: химические свойства, аллотропия #углерод #химшкола #неметаллы #егэхимияСкачать

Конструкционные и инструментальные углеродистые сталиСкачать

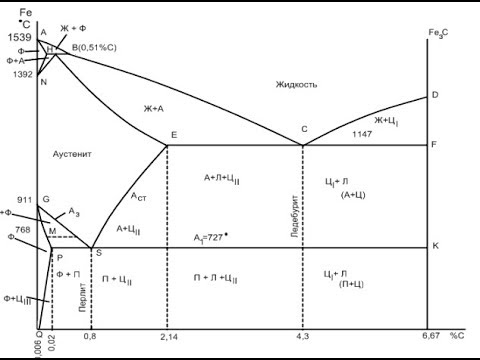
ДИАГРАММА СОСТОЯНИЯ ЖЕЛЕЗО-ЦЕМЕНТИТ, железо-углерод, Fe+Fe3CСкачать
Химические элементы: углеродСкачать

248) Диаграмма железо - углерод (материаловедение)Скачать

ДИАГРАММА ЖЕЛЕЗО-УГЛЕРОД [МАТЧАСТЬ]Скачать
![ДИАГРАММА ЖЕЛЕЗО-УГЛЕРОД [МАТЧАСТЬ]](https://i.ytimg.com/vi/L1VZ5rbqL7Q/0.jpg)
Химические свойства элементов 14 (IVA) группы и их соединений. 1 часть. 11 класс.Скачать

Как БЫСТРО понять Химию? Органическая Химия с нуляСкачать

Опыты с углеродом. ХимияСкачать

Подгруппа углерода. Неорганическая химия. Видеоурок #16Скачать

Химические свойства углеродаСкачать

Виды сталей и их расшифровка.Скачать

Углерод и его аллотропные формы алмаз и графит (Киевнаучфильм)Скачать

СТРОЕНИЕ АТОМА ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Углерод. Видеоурок 33. Химия 9 классСкачать
