Оксиды — это химические соединения, состоящие из атомов кислорода и других элементов. Они являются одними из наиболее распространенных соединений в химии и имеют разнообразные свойства и применение. Классификация оксидов основывается на типе их химической связи и составе, что определяет их физические и химические свойства.
Основными видами оксидов являются сульфиды, оксиды металлов и неметаллические оксиды. Сульфиды образуются при взаимодействии кислорода с серой и обладают характерным запахом и высокой токсичностью. Оксиды металлов представляют собой соединения, где кислород связан с атомами металла, обладают высокой температурой плавления и являются отличными проводниками электричества. Неметаллические оксиды образуются при соединении кислорода с неметаллами и обладают различными свойствами.
Оксиды также могут быть основными, кислотными и амфотерными. Основные оксиды реагируют с водой, образуя основания. Кислотные оксиды образуют при взаимодействии с водой кислоты. Амфотерные оксиды являются и кислотными и основными оксидами, то есть могут взаимодействовать как с кислотами, так и с основаниями.
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Оксиды металлов
Оксиды металлов могут иметь разные степени окисления металла и формироваться путем соединения металла с кислородом. Они могут быть как двухвалентными, так и многовалентными.
Оксиды металлов выполняют различные функции в природе и в промышленности. Некоторые из них используются в качестве катализаторов, другие — в процессе производства стекла и керамики. Некоторые оксиды металлов также играют роль в медицине и пищевой промышленности.
Некоторые из наиболее распространенных оксидов металлов включают:
- Оксид железа (FeO, Fe2O3)
- Оксид алюминия (Al2O3)
- Оксид меди (CuO)
- Оксид свинца (PbO)
- Оксид цинка (ZnO)
- Оксид азота (NO)
Каждый из этих оксидов имеет свои специфические свойства и применения в различных отраслях науки и промышленности.
Оксиды щелочных металлов
Оксиды щелочных металлов образуются в результате сочетания соответствующего щелочного металла с кислородом. Общая формула оксидов щелочных металлов может быть представлена как M2O, где M представляет собой атом щелочного металла.
Оксиды щелочных металлов обладают особыми свойствами. Они являются сильными основаниями и легко реагируют с водой, образуя гидроксиды щелочных металлов. Растворы гидроксидов щелочных металлов обладают щелочными свойствами и обычно имеют pH значение выше 7.
Оксиды щелочных металлов также используются в различных промышленных процессах и производствах. Например, оксиды натрия (Na2O) и калия (K2O) часто используются в производстве стекла и керамики, благодаря своим особым свойствам при нагревании.
Таким образом, оксиды щелочных металлов представляют собой важную группу оксидов, которые широко используются в различных областях и обладают уникальными свойствами и химическими реакциями.
Оксиды щелочноземельных металлов
Оксиды щелочноземельных металлов представляют собой химические соединения, состоящие из кислорода и щелочноземельного металла. Они обладают высокой степенью ионизации и образуют сильно щелочные растворы.
Одним из самых распространенных оксидов щелочноземельных металлов является оксид кальция, CaO, также известный как известь. Он широко используется в строительстве для производства цемента и известняка.
Оксид магния, MgO, также известный как магнезия, является еще одним важным оксидом в данной группе. Он применяется в производстве огнеупорных материалов, керамики, стекла и литейных форм.
Оксид стронция, SrO, обладает хорошей электроизоляцией и используется в производстве электрических изоляторов.
Оксид бария, BaO, является компонентом некоторых стекловидных материалов и используется в производстве эмалей и катализаторов.
Все эти оксиды щелочноземельных металлов обладают различными свойствами и находят широкое применение в различных отраслях промышленности и науки.
Оксиды переходных металлов
Переходные металлы имеют возможность образовывать различные валентности, что влияет на свойства оксидов. В основном, оксиды переходных металлов являются твердыми веществами, но некоторые из них могут быть газообразными или жидкими при определенных условиях.
Оксиды переходных металлов обладают различными химическими и физическими свойствами. Они могут иметь разные степени окисления переходного металла, что влияет на их кислотно-щелочные свойства и реакционную способность.
Некоторые из наиболее известных оксидов переходных металлов включают оксид железа (Fe2O3), оксид меди (CuO), оксид цинка (ZnO), оксид титана (TiO2) и оксид хрома (Cr2O3).
- Оксид железа (Fe2O3) — используется в производстве стали и красок.
- Оксид меди (CuO) — применяется в электронике и керамике.
- Оксид цинка (ZnO) — широко используется в солнцезащитных кремах и лекарствах.
- Оксид титана (TiO2) — используется как пигмент в красках и пластиках.
- Оксид хрома (Cr2O3) — применяется в качестве пигмента и катализатора.
Оксиды переходных металлов имеют широкий спектр применений в различных областях, включая промышленность, электронику, строительство и медицину.
Видео:Типы оксидов за 2 минуты (8 классам)Скачать
Оксиды неметаллов
Оксиды неметаллов могут иметь различные степени окисления своих компонентов. Например, углекислота (CO2) – это оксид углерода, в котором кислород имеет степень окисления -2, а углерод – +4. Еще одним примером является оксид азота (NO2), в котором кислород имеет степень окисления +4, а азот – +2.
Оксиды неметаллов играют важную роль в химической и промышленной отраслях. Они используются в производстве различных материалов, таких как стекло, керамика и пластик. Кроме того, оксиды неметаллов являются важными компонентами в лекарствах, косметике и других товарах повседневного спроса.
Оксиды кислорода
Оксиды кислорода могут быть разделены на несколько основных видов:
1. Диоксид кислорода (CO2) — это один из самых известных оксидов кислорода. Он образуется при сжигании углерода и органических веществ, а также при дыхании живых организмов. Диоксид кислорода является главным газовым составляющим атмосферы Земли и играет важную роль в углеродном цикле.
2. Трехокись азота (N2O3) — это один из нестабильных оксидов кислорода. Он образуется при реакции азотной кислоты с пероксидом водорода. Трехокись азота используется в химической промышленности и лабораторных условиях
3. Пятиокись фосфора (P4O5) — это оксид кислорода, который образуется при сжигании фосфора в кислороде. Пятиокись фосфора используется в химической промышленности для получения фосфорной кислоты и других соединений.
Это лишь некоторые примеры оксидов кислорода. Некоторые из них имеют важное промышленное и научное применение, а другие являются природными продуктами химических реакций и процессов в природе.
Оксиды азота
| Название оксида | Химическая формула | Степень окисления азота | Свойства и применение |
|---|---|---|---|
| Оксид азота(I) | N2O | +1 | Оказывает эффект анестезии, используется в медицине и в пищевой промышленности. |
| Оксид азота(II) | NO | +2 | Является важным сигнальным молекулом в организмах живых организмов. |
| Оксид азота(III) | N2O3 | +3 | Применяется в процессах нитрирования и в производстве кислородного азота. |
| Оксид азота(IV) | N2O4 | +4 | Используется в процессах окисления и при синтезе органических соединений. |
| Оксид азота(V) | N2O5 | +5 | Применяется в качестве окислителя, а также в процессе нитрации. |
Оксиды азота имеют различные применения в разных отраслях науки и промышленности. Они являются важными соединениями в химической и медицинской промышленности, а также играют роль в живых организмах.
Оксиды серы
Еще одним оксидом серы является трехокись серы (SO3), которая образуется при окислении диоксида серы. Трехокись серы обладает высокой реакционной способностью и используется в промышленности для производства серной кислоты.
Также существуют другие оксиды серы, такие как монооксид серы (SO), которые образуются при неполном сгорании серы. Они имеют меньшую практическую значимость и редко встречаются в природе.
Оксиды серы используются в различных отраслях промышленности, в том числе при производстве удобрений, красителей, пестицидов и других химических соединений. Они также являются важными промышленными загрязнителями, так как способны вызывать кислотные дожди и негативно влиять на экологию и здоровье человека.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Оксиды металлоидов
Одним из известных оксидов металлоидов является оксид кремния (SiO2), также известный как кварц. Оксид кремния широко используется в промышленности, например, в производстве стекла и керамики. Он также является основным компонентом песчаника и песчаных пляжей.
Другим примером оксида металлоида является оксид бора (B2O3). Он используется в производстве стекла, керамики, эмали и неорганических кислот. Оксид бора также может использоваться в качестве компонента в противопожарных и антифрикционных материалах.
Оксид арсения (As2O3) — еще один пример оксида металлоида. Он используется в производстве стекла, эмалей, фоточувствительных материалов и других химических соединений.
Оксиды металлоидов имеют широкий спектр применений в различных отраслях промышленности и науки. Их свойства зависят от конкретного металлоида и могут быть изменены с помощью дополнительных элементов и способов обработки.
Оксиды кремния
Главным представителем оксидов кремния является диоксид кремния, известный также как кремнезем (SiO2). Кремнезем обладает высокой устойчивостью к химическим и физическим воздействиям и широко используется в различных отраслях промышленности. Он является основным компонентом стекла, керамики, цемента, а также используется в производстве полупроводниковых материалов.
Оксид кремния также может иметь другие модификации, такие как трехоксид кремния (SiO3) и оксид кремния (II) (SiO). Эти модификации обладают своими уникальными свойствами и применяются в различных отраслях науки и техники.
Из оксидов кремния также можно получать различные соединения, такие как кремнийорганические соединения и кремнийсодержащие полимеры. Они обладают широким спектром свойств и применяются в различных областях, включая медицину, электронику и химическую промышленность.
- Диоксид кремния (кремнезем) (SiO2)
- Трехоксид кремния (SiO3)
- Оксид кремния (II) (SiO)
Оксиды кремния играют важную роль в природе и технике. Их уникальные свойства и широкий спектр применений делают их незаменимыми компонентами во многих отраслях промышленности и научных исследований.
Оксиды фосфора
1. Фосфорус(P4O6) – это оксид фосфора (III) или оксид трифосфора. Соединение имеет простую формулу и состоит из 4 атомов фосфора и 6 атомов кислорода. Оно образуется при неполном сгорании белого фосфора воздухе. Фосфорус имеет ядовитые свойства и может вызывать ожоги при контакте с кожей или слизистыми оболочками.
2. Фосфоран(V)(P4O10) – это оксид фосфора (V) или оксид десятифосфора. Он представляет собой более сложное соединение, состоящее из 4 атомов фосфора и 10 атомов кислорода. Фосфоран(V) образуется при полном сгорании белого фосфора воздухе. Он является белым твёрдым веществом, которое реагирует с водой, образуя ортофосфорную кислоту (H3PO4).
3. Фосфаты – это соли фосфорной кислоты (H3PO4). Они широко распространены в природе и играют важную роль в биологических процессах. Фосфаты используются в производстве удобрений, пластиков, стекла и других материалов.
Оксиды фосфора являются важными соединениями фосфора и находят применение в различных областях, включая химическую промышленность и медицину.
Оксиды мышьяка
Одной из групп соединений мышьяка являются оксиды. Оксиды мышьяка образуются при соединении мышьяка с кислородом. Природа оксидов мышьяка может быть различной, в зависимости от степени окисления и других факторов. Некоторые из наиболее известных оксидов мышьяка представлены в таблице нижней.
| Название оксида | Химическая формула |
|---|---|
| Оксид мышьяка(III) | As4O6 |
| Оксид мышьяка(V) | As2O5 |
Оксид мышьяка(III) представляет собой двойникыонную кислоту соединение, в котором каждый атом мышьяка соединен с двумя атомами кислорода. Он имеет положительный заряд и активно взаимодействует с другими веществами.
Оксид мышьяка(V) образуется при окислении мышьяка в присутствии кислорода. Это кислота более высокой окислительной способностью, так как у молекулы мышьяка есть две электроотрицательные кислородные атомы.
Оксиды мышьяка широко используются в промышленности, в процессе производства стекла, электроники и полупроводников. Они также могут использоваться как ядовитые агенты, и поэтому требуют особой осторожности при работе с ними.
Видео:8 класс Оксиды, названия оксидов, классификация оксидов (основные, кислотные, амфотерные)Скачать

Оксиды легких металлов
Оксиды легких металлов имеют разнообразные физические и химические свойства. Например, оксид лития (Li2O) является белым кристаллическим веществом, хорошо растворимым в воде. Он используется в производстве литиевых батарей и керамики.
Оксид натрия (Na2O) имеет вид бесцветных кристаллов или желтоватого порошка. Он реагирует с водой, образуя гидроксид натрия и выделяя большое количество тепла. Оксид натрия используется в производстве стекла, мыла и щелочей.
Оксид калия (K2O) образует белые кристаллы или порошок. Он растворим в воде и реагирует с водой, образуя гидроксид калия. Оксид калия применяется в промышленности для производства стекла, удобрений и щелочей.
Оксид магния (MgO) образует белые кристаллы или порошок. Он практически нерастворим в воде, но растворяется в кислотах. Оксид магния используется в производстве керамики, огнеупорных материалов и лекарств.
Оксид кальция (CaO), известный также как незбеливанное известь, является белым кристаллическим веществом. Он реагирует с водой, образуя гидроксид кальция и выделяя большое количество тепла. Оксид кальция широко используется в строительстве, производстве цемента и сельском хозяйстве.
Оксиды бериллия
Оксиды бериллия представляют собой соединения бериллия с кислородом. Существуют два основных оксида бериллия: BeO и BeO2.
BeO, или оксид бериллия, является белым кристаллическим веществом с высокой температурой плавления. Он обладает высокой теплопроводностью и широко используется в электронике, например, в качестве изолятора и материала для термических ядерных реакторов.
BeO2, или диоксид бериллия, является менее распространенным соединением. Он имеет темно-коричневый цвет и образуется при взаимодействии оксида бериллия с кислородом при высоких температурах и давлениях. Диоксид бериллия также используется в различных технических приложениях.
Оксиды бериллия обладают высокой токсичностью и могут вызывать серьезные заболевания дыхательной системы. При работе с этими веществами необходимо соблюдать все меры предосторожности и использовать средства индивидуальной защиты.
Оксиды алюминия
Алюминий оксид используется в широком спектре промышленных приложений. Он является основной сырьевой материал для производства алюминиевой фольги, металлокерамических композитов и огнеупорных изделий.
Кроме того, алюминий оксид применяется в области косметики и фармацевтики. Он используется в производстве косметических средств, таких как пудра и кремы, благодаря своим абсорбирующим свойствам и способности создавать защитную пленку на коже.
Интересный факт: алюминий оксид также используется в производстве стекла, где он служит стабилизатором и придает стеклу прочность и прозрачность.
🔥 Видео
Классификация оксидов | 8-11 классыСкачать

Химия 8 класс (Урок№15 - Оксиды: классификация, номенклатура.)Скачать

40. Оксиды. КлассификацияСкачать

ОКСИДЫ основные кислотные амфотерные как отличить | Оксиды химия 8 классСкачать

Оксиды. Химические свойства. 8 класс.Скачать

Оксиды. 1 часть. 8 класс.Скачать
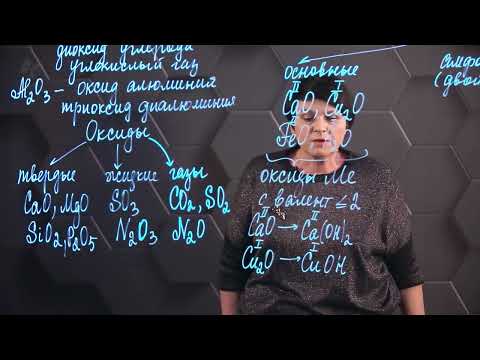
Оксиды, их классификация и свойства. Химия 8 классСкачать

Получение и химические свойства ОКСИДОВ 8 класс | ПРИНЦИП составления реакций с участием оксидовСкачать

Реакция на результаты ЕГЭ 2022 по русскому языкуСкачать

Характеристика и химические свойства оксидов | Химия ЕГЭ 10 класс | УмскулСкачать

Оксиды | Химия | TutorOnlineСкачать

Оксиды: химические свойства и классификация | Химия #оксиды #химия #егэхимияСкачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Составление формулы оксидов. ПримерСкачать

Это Самый Простой Урок Химии. Химия с нуля — АмфотерностьСкачать

68 учеников этого НЕ ЗНАЮТ! Таблица Менделеева — Как пользоваться?Скачать
