Ацетон – это органическое соединение, простейший представитель кетонов. Он широко используется в промышленности и быту благодаря своим физическим и химическим свойствам. Давайте подробнее рассмотрим, из чего состоит ацетон, и изучим его химический состав.
Химическую формулу ацетона можно представить как C3H6O. В его молекуле три атома углерода соединены с шестью атомами водорода и одним кислородом. Молекула ацетона обладает уникальной структурой, где кислород цепляется к углероду через двойную связь.
Ацетон обладает легкими физическими свойствами. При комнатной температуре он представляет собой прозрачную жидкость без цвета и особого запаха. Он хорошо смешивается с водой, спиртом и многими органическими растворителями. Ацетон обладает низкой вязкостью и низкой температурой кипения, что делает его прекрасным растворителем для ряда веществ.
Ацетон является очень важным промышленным химическим веществом. Он широко используется в процессе производства пластмасс, смол и лаков. Ацетон также находит применение в косметической и фармацевтической промышленности, а также в некоторых бытовых средствах.
- Ацетон и его химический состав
- Определение и области применения
- Физические свойства ацетона
- Химический состав ацетона
- Состав и структура молекулы ацетона
- Формула ацетона
- Из чего состоит ацетон?
- Происхождение ацетона
- Химический состав исходных веществ при производстве ацетона
- Свойства и реакции ацетона
- Физические свойства ацетона
- Химические реакции ацетона
- Опасность и меры предосторожности при работе с ацетоном
- Токсичность ацетона
- Меры предосторожности при использовании ацетона
- 📸 Видео
Видео:Получение АЦЕТОНАСкачать

Ацетон и его химический состав
Ацетон выглядит как прозрачная, бесцветная жидкость с характерным запахом. Он обладает легкими летучими свойствами и быстро испаряется при комнатной температуре. Этот химический соединение не растворяется в воде, но хорошо смешивается с многими органическими растворителями.
Атомы углерода в ацетоне связаны между собой двойными связями, а атмом кислорода соединен с одним аатомом углерода. Эта структура делает ацетон стабильным и позволяет ему быть использованным для различных целей.
Ацетон широко используется в промышленности как растворитель для многих органических веществ. Он также находит применение в лакокрасочной промышленности, медицине (для удаления клея и лака с кожи), а также в бытовых целях для удаления краски и клея.
Опасно использовать ацетон без должной предосторожности, так как он легко воспламеняется и является токсичным. При работе с ацетоном необходимо использовать средства защиты, такие как перчатки и маски. Также не рекомендуется использование ацетона в закрытых помещениях, где отсутствует вентиляция.
- Химическая формула: C3H6O
- Внешний вид: прозрачная, бесцветная жидкость
- Характерный запах
- Летучий и быстро испаряющийся
- Не растворяется в воде, смешивается с органическими растворителями
- Используется в промышленности, медицине и для бытовых целей
- Условия безопасного использования: средства защиты и хорошая вентиляция
Определение и области применения
Ацетон широко применяется в химической и фармацевтической индустрии в качестве растворителя, высокоэффективного средства для очистки и удаления загрязнений. Благодаря его способности растворять многие органические вещества, ацетон является неотъемлемой частью процессов разработки и производства лаков, клеев, смол и пластмасс.
Ацетон также находит применение в различных областях быта и домашнего использования. Он используется в процессе снятия лака с ногтей, растворения клея, удаления пятен или размывания красок.
В лабораторных исследованиях ацетон широко используется для чистки и дезинфекции поверхностей, стерилизации инструментов и растворения определенных аналитических проб. Его свойство быстро испаряться и образовывать пары делает его отличным средством для очистки стекла, научных приборов и оптических элементов.
| Области применения ацетона: |
|---|
| Промышленность и производство |
| Фармацевтическая промышленность |
| Строительство |
| Бытовое использование |
| Научные исследования и лаборатории |
Физические свойства ацетона
Температура кипения ацетона составляет 56,53 °C, а его плотность – около 0,79 г/см³ при 20 °C. Это означает, что ацетон легче воды и может быстро выпариваться.
Ацетон обладает низкой вязкостью и высокой скоростью испарения, что делает его полезным в различных промышленных процессах и бытовых ситуациях.
Важным свойством ацетона является его способность смачивать различные поверхности. Он может легко очищать пластик, стекло и металлы от следов клея, масел и других загрязнений.
Ацетон также является легким воспламеняющимся веществом, поэтому он должен использоваться с особой осторожностью. Вещество разлагается под действием света и воздуха, поэтому рекомендуется хранить его в плотно закрытой таре в холодном и темном месте.
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Химический состав ацетона
Ацетон является органическим растворителем, поскольку он способен растворять множество органических и некоторых неорганических веществ. В частности, ацетон хорошо растворяет масла, жиры, смолы и клеи, что делает его полезным во многих отраслях промышленности.
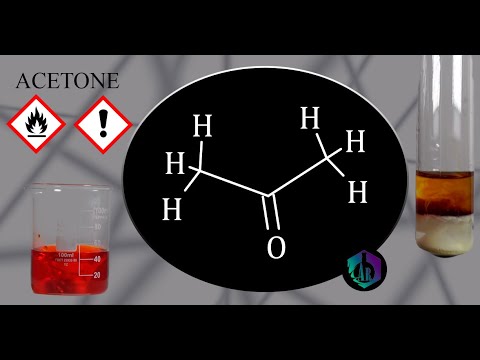
Химический состав ацетона можно рассмотреть более подробно. Он состоит из 3 углеродных атомов (C), 6 атомов водорода (H) и 1 атома кислорода (O). Структурно ацетон можно представить в виде трехатомного кольца, где кислородом связаны две углеродных группы. Такая структура делает ацетон молекулой, обладающей высокой степенью реакционной активности.
| Химический элемент | Количество атомов |
|---|---|
| Углерод (C) | 3 |
| Водород (H) | 6 |
| Кислород (O) | 1 |
Из-за своей простой структуры и химической активности ацетон широко используется в лабораториях, косметической и фармацевтической промышленности, а также в процессах очистки и отделки различных поверхностей.
Состав и структура молекулы ацетона
Молекула ацетона состоит из трех атомов углерода, шести атомов водорода и одного атома кислорода. Ее химическая формула C3H6O указывает на то, что в ацетоне присутствуют два атома углерода, связанные с кислородом двойной связью. Каждый атом углерода также связан с двумя атомами водорода, образуя алкильные группы. Молекула ацетона имеет треугольную плоскую конфигурацию.
Структурная формула ацетона CH3-C(=O)-CH3 объясняет его свойства и реакционную способность. Связь между углеродом и кислородом называется карбонильной связью, которая делает ацетон альдегидом и кетоном одновременно.
Молекула ацетона обладает плоскостью симметрии, поэтому она не имеет хиральных центров и не является оптическим изомером. Межатомные связи в молекуле ацетона являются ковалентными.
С точки зрения электронной структуры, молекула ацетона содержит σ- и π-связи. Сигма-связь формируется между атомами углерода и водорода, а также между атомами углерода и кислорода, а пи-связь образуется за счет перекрытия п-орбиталей атомов углерода и атома кислорода.
Состав и структура молекулы ацетона являются основой для его физических и химических свойств, а также активности во множестве реакций и применений в различных областях науки и промышленности.
Формула ацетона
Молекула ацетона состоит из трех атомов углерода (C), шести атомов водорода (H) и одного атома кислорода (O). Ацетон имеет структуру с двойной связью между одним из углеродных атомов и кислородом.
Формула ацетона можно представить так: CH3-CO-CH3 или CH3C(O)CH3, где CH3 обозначает метильную группу (-CH3), а CO обозначает кетогруппу (-CO-).
Видео:АцетонСкачать

Из чего состоит ацетон?
Ацетон имеет типичный запах и легко смешивается с водой, спиртом и другими органическими растворителями. Он является жидкостью без цвета, при комнатной температуре, легко испаряющейся.
Химический состав ацетона делает его поларным аполярным соединением. В молекуле ацетона кислородный атом связан с двумя атомами углерода и образует карбонильную группу (C=O). Эта карбонильная группа придает ацетону химическую активность и способность участвовать во многих химических реакциях.
Таким образом, ацетон можно описать как простое органическое соединение, состоящее из углерода, водорода и кислорода, с карбонильной группой, которая определяет его химические свойства и активность.
Происхождение ацетона
В человеческом организме ацетон образуется при окислении жирных кислот. Важную роль в этом процессе играют такие органы, как печень и почки. Кроме того, ацетон может возникать в результате голодания, длительного физического напряжения или при нарушении обмена веществ.
Ацетон также обнаруживается в природной среде. Его образование происходит при ферментативной переработке органических веществ. Например, после перегнивания органических отходов ацетон может появиться в почве.
Каким бы путем ацетон ни образовывался, он обладает химической формулой C3H6O и является наиболее простым и известным представителем кетонов. Благодаря своим свойствам, ацетон широко используется в промышленности и в быту.
Химический состав исходных веществ при производстве ацетона
| Исходное вещество | Химическая формула |
|---|---|
| Пропанол-2 | C₃H₈О |
| Ацетальдегид | C₂H₄O |
| Этилен | C₂H₄ |
Процесс получения ацетона обычно происходит путем ацетилирования пропанол-2 или окисления ацетальдегида. При этом исходные вещества претерпевают химические реакции и превращаются в ацетон.
Пропанол-2 (C₃H₈О) является пропанолом, в котором гидроксильная группа (-OH) замещена ацетильной группой (-COCH₃). Ацетальдегид (C₂H₄O) представляет собой соединение, содержащее карбонильную группу (-CHO) и используется в качестве промежуточного продукта при синтезе ацетона. Этилен (C₂H₄) является газообразным углеводородом, который может быть окислен до ацетона с использованием специальных окислителей.
Исходные вещества при производстве ацетона являются химически активными и реагируют между собой с образованием ацетона. Этот процесс требует проведения в специальных условиях и при наличии катализаторов, чтобы обеспечить высокую эффективность и выход продукта.
Таким образом, химический состав исходных веществ при производстве ацетона включает пропанол-2, ацетальдегид и этилен. Эти соединения проходят химические превращения и реакции, что позволяет получить ацетон, который широко используется в промышленности и бытовых целях.
Видео:Синтез АЦЕТОНА из ИЗОПРОПИЛОВОГО спирта. Качественная реакция на АЦЕТОНСкачать
Свойства и реакции ацетона
Ниже представлена таблица с основными свойствами и реакциями ацетона:
| Свойство/Реакция | Описание |
|---|---|
| Температура кипения | — низкая (56,5 °C), что делает его легко испаряющимся веществом. |
| Огнеопасность | — ацетон легко воспламеняется и горит с ярким пламенем. |
| Растворимость | — хорошо растворяется в воде и многих органических растворителях, таких как этанол и эфир. |
| Реакция с основаниями | — сильное основание (например, гидроксид натрия) вызывает реакцию гидролиза, при которой образуется спирт и соль. |
| Окисление | — в присутствии кислорода ацетон может окисляться до образования кислот, таких как уксусная кислота. |
| Реакция с галогенами | — ацетон может реагировать с галогенированными соединениями и алкалами, образуя галогенпропаны и алкилпропионаты соответственно. |
Это лишь некоторые из свойств и реакций, характерных для ацетона. Этот органический растворитель играет важную роль во многих областях, таких как промышленность, наука и медицина.
Физические свойства ацетона
Температура кипения ацетона составляет примерно 56,2 °C, что делает его легким для испарения при комнатной температуре. Он обладает довольно низкой вязкостью и хорошей растворимостью, что делает его полезным растворителем в различных процессах.
Ацетон обладает также высокой теплопроводностью, что в сочетании с его низкой температурой воспламенения делает его легковоспламеняемым веществом. Он может сгореть, образуя яркий пламя, в контакте с открытым источником огня, и поэтому должен храниться и использоваться с осторожностью.
Кроме того, ацетон является летучим веществом и быстро испаряется при комнатной температуре. Это делает его полезным в качестве растворителя и очистителя в различных промышленных процессах и лакокрасочных работах.
Химические реакции ацетона
Вот некоторые из химических реакций, в которых может участвовать ацетон:
1. Окисление ацетона: Ацетон может окисляться с помощью окислителей, таких как перманганат калия или хромовую смесь с серной кислотой. В результате этой реакции образуется уксусная кислота:
CH3C(O)CH3 + [O] → CH3C(O)OH
2. Присоединение ацетона к аммиаку: При нагревании аммиака с ацетоном происходит реакция, при которой ацетон присоединяется к аммиаку и образуется соединение, известное как ацетоамид:
CH3C(O)CH3 + NH3 → CH3C(O)NH2 + H2O
3. Превращение ацетона в глицерин: Один из способов получения глицерина — реакция превращения ацетона в глицерин в присутствии щелочи и никель катализатора:
CH3C(O)CH3 + 3NaOH + Ni → C3H8O3 + Na2CO3 + NiO
4. Превращение ацетона в изопропанол: Ацетон может использоваться как исходное вещество для получения изопропанола. При этом происходит реакция превращения одного молекулы ацетона в одну молекулу изопропанола:
CH3C(O)CH3 → (CH3)2CHOH
Это лишь некоторые примеры химических реакций, в которых может участвовать ацетон. Этот органический соединение имеет многочисленные применения в различных отраслях промышленности и научных исследованиях, благодаря его способности к химическим превращениям.
Видео:Экстракция (выделение) веществ из растенийСкачать

Опасность и меры предосторожности при работе с ацетоном
Опасность:
Ацетон является летучим и воспламеняющимся веществом, что делает его потенциально опасным в использовании. При вдыхании паров ацетона возможны различные побочные эффекты, включая головную боль, головокружение, тошноту и даже потерю сознания. Контакт с ацетоном также может вызывать раздражение кожи и глаз, а в случае попадания на слизистые оболочки может привести к ожогам.
Меры предосторожности:
При работе с ацетоном следует соблюдать следующие меры предосторожности:
- Носить защитные перчатки, очки и одежду, чтобы предотвратить контакт с ацетоном.
- Работать в хорошо проветриваемом помещении или под вытяжкой, чтобы минимизировать вдыхание паров ацетона.
- Избегать открытого огня или источников искры вблизи ацетона, так как он является легковоспламеняющимся веществом.
- Хранить ацетон в безопасных условиях, вдали от источников тепла и огня.
- При случайном попадании ацетона на кожу или в глаза, немедленно промыть большим количеством воды и обратиться за медицинской помощью.
Соблюдение указанных мер предосторожности поможет защитить себя от возможных опасностей при работе с ацетоном и обеспечит безопасное использование этого химического вещества.
Токсичность ацетона
- Вдыхание ацетона может привести к раздражению слизистых оболочек дыхательных путей и глаз.
- Продолжительное воздействие ацетона может вызвать головную боль, головокружение, слабость и сонливость.
- Ацетон оказывает вредное воздействие на нервную систему человека, вызывая нарушения координации движений и снижение концентрации внимания.
- При попадании ацетона на кожу может возникнуть раздражение и сухость кожи.
- При попадании ацетона в желудок может произойти ожог слизистой оболочки, тошнота, рвота и желудочное кровотечение.
Понимание токсичности ацетона важно при работе с ним, чтобы предотвратить возможные опасности и принять необходимые меры безопасности.
Меры предосторожности при использовании ацетона
| Меры предосторожности | Описание |
|---|---|
| Вентиляция | Работайте только в хорошо проветриваемых помещениях или под капюшоном с вытяжной системой. Ацетон выделяет пары, которые при длительном вдыхании могут вызывать головокружение, тошноту и другие неприятные ощущения. |
| Избегайте источников огня | Ацетон является очень легковоспламеняющимся веществом. Не допускайте попадания открытого источника огня или искр вблизи ацетона, чтобы избежать возгорания или взрыва. |
| Соблюдайте меры личной безопасности | При работе с ацетоном необходимо надеть защитные рукавицы, предохранительные очки и халат. Избегайте контакта ацетона с кожей и глазами, так как это вещество может вызвать раздражение и ожоги. |
| Храните ацетон в надлежащем контейнере | Ацетон следует хранить в плотно закрытых контейнерах, изготовленных из материалов, устойчивых к его воздействию. Обеспечьте надежную систему хранения, чтобы предотвратить утечку ацетона и его испарение в окружающую среду. |
| Используйте ацетон только по назначению | Не используйте ацетон для других целей, кроме предназначенных. Следуйте указаниям и рекомендациям производителя, чтобы избежать неправильного использования и потенциальных опасностей. |
Соблюдение вышеперечисленных мер предосторожности является важным условием безопасной работы с ацетоном. Будьте внимательны и осторожны, чтобы избежать возможных несчастных случаев или негативных последствий для здоровья.
📸 Видео
ЧТО РАСТВОРЯЕТ АЦЕТОНСкачать

Откуда берётся ацетон? - Доктор КомаровскийСкачать

Ацетон что это и как это работаетСкачать

Почему появляется ацетон? - Доктор КомаровскийСкачать

Химические свойства алканов. 1 часть. 10 класс.Скачать

Получение (синтез) ацетона (synthesis of acetone) CH3COCH3Скачать

Чепраков А.В.-Координационные соединения переходных металлов- 3. Классическое кросс-сочетаниеСкачать

Получение Йодоформа. Реакция Ацетона, Йода и Гидрооксида Натрия. Реакция C3H6O, I2 и NaOH.Скачать

Строение атома. Как составить электронную и электронно-графическую формулы?Скачать

7 ПРОСТЫХ ХИМИЧЕСКИХ ОПЫТОВ!Скачать

Химические свойства алканов | Химия ЕГЭ для 10 класса | УмскулСкачать

химическая реакция. В банке. Фонарик из меди и ацетонаСкачать

Ацетат кальция и ацетонСкачать

Получение ацетона из ацетата кальция | Getting acetone from calcium acetateСкачать

Теперь скуплю всю стружку! Это ЗОЛОТО, а не мусор!Скачать
