Галогены — это группа химических элементов периодической таблицы, состоящая из четырех элементов: фтора (F), хлора (Cl), брома (Br) и йода (I). Эти элементы имеют не только интересные свойства, но и широкое применение в различных областях жизни. Если вы хотите узнать больше о галогенах и их значении для нашего мира, то давайте начнем!
Первым элементом галогенов является фтор. Он обладает яркой желтым цветом и высокой реактивностью. Фтор является самым электроотрицательным химическим элементом и одним из самых сильных окислителей. Благодаря этим свойствам, фтор используется в производстве многочисленных продуктов, включая бытовую химию, лекарства и пищевые добавки.
Вторым элементом галогенов является хлор. Хлор известен своими антимикробными свойствами и используется для очистки воды и бассейнов, а также в производстве пластиков и многих других продуктов. Но, несмотря на полезные свойства, должно быть аккуратным с хлором, так как его пары могут быть опасными для дыхательной системы и глаз.
Третьим элементом галогенов является бром. Бром обладает жидким агрегатным состоянием при комнатной температуре, что делает его уникальным. Бром используется в производстве огнезащитных и антиокислительных веществ, а также в фотографии и лекарствах. Кроме того, бром является неотъемлемым элементом в медицине и сельском хозяйстве.
Видео:Галогены: фтор, хлор, бром и иод | Химические свойства #галогены #химия #видеоурок #егэхимияСкачать

Галогены и их свойства
Физические свойства галогенов:
- Фтор — желтовато-зеленый газ с резким запахом. Он является самым активным из всех галогенов и обладает наибольшей электроотрицательностью. Фтор образует ядовитый газовый элементарный галоген.
- Хлор — зеленовато-желтый газ с резким запахом. Он менее активен, чем фтор, но все равно обладает высокой электроотрицательностью. Хлор широко используется в промышленности, включая производство пластмасс и очистку воды.
- Бром — красно-коричневая жидкость с неприятным запахом. Он менее активен, чем фтор и хлор, но все равно является реактивным химическим элементом. Бром применяется, в том числе, в фармацевтической и агропромышленной отраслях.
- Йод — блестящий, темное фиолетового цвета кристалл. Он самый низкоактивный из всех галогенов и сравнительно безопасен. Йод используется в медицине, производстве красителей и для обогащения пищевых продуктов.
Химические свойства галогенов:
- Галогены легко образуют соединения с другими элементами. Например, они могут образовывать соли с металлами, такие как натрий (Na) и калий (K).
- Галогены способны образовывать ковалентные связи с другими неметаллами.
- Они являются окислителями и могут участвовать в реакциях окисления.
- Галогены обладают электрофильными свойствами, то есть они способны притягивать электроны.
Галогены играют ключевую роль в природе и нашей жизни. Например, хлор используется для очистки питьевой воды и бассейнов. Фтор применяется для защиты зубов от кариеса. Бром применяется в огнезащитных материалах и фармацевтической промышленности. Йод является необходимым элементом для нормальной работы щитовидной железы.
Видео:Галогены. Видеоурок 22. Химия 9 класс.Скачать

Что такое галогены?
В таблице периодических элементов галогены расположены в VII группе. Они имеют электронную конфигурацию [нoble gas] ns²np⁵, где [noble gas] представляет последний инертный газ перед галогеном в данном периоде. Все галогены имеют семь электронов на своих внешних энергетических оболочках, что делает их очень реактивными.
Физически свойства галогенов включают низкие температуры плавления и кипения, а также хорошую растворимость в воде. Например, фтор и хлор являются газами при комнатной температуре и давлении, бром — жидкостью, а йод — твердым веществом. Они обладают ярким цветом, например, фтор светло-желтый, хлор зеленый, бром красно-коричневый и йод фиолетовый.
Химические свойства галогенов тоже очень разнообразны. Они являются сильными окислителями и легко вступают в реакции с другими элементами. Например, они могут образовывать соли с щелочными металлами, такие как натрий или калий. Более того, галогены могут образовывать соединения с другими неорганическими и органическими веществами, обладая такими свойствами, как антисептические или дезинфицирующие свойства.
Галогены играют ключевую роль в природе и нашей жизни. Они широко используются в различных областях, включая производство пластмасс, лекарств, водоочистку, а также в качестве дезинфицирующих средств и отбеливателей. Некоторые галогены, такие как йод и фтор, также являются важными для поддержания здоровья человека.
Натуральные источники галогенов включают морскую воду, где присутствуют ионы хлора, а также некоторые минералы, содержащие бром и йод. Они также могут быть получены путем химического синтеза.
Таким образом, галогены представляют собой важную группу элементов периодической системы, которые имеют разнообразные физические и химические свойства. Их использование в различных областях делает их неотъемлемой частью нашей жизни.
Галогены в периодической системе
Галогены входят в группу VIIA периодической системы химических элементов. Они состоят из следующих элементов: фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At).
Галогены располагаются справа от группы алкалиновых металлов и алкалиноземельных металлов. Они являются самыми электроотрицательными элементами в периодической системе и обладают особыми химическими свойствами.
Галогены образуют молекулы, состоящие из двух атомов, например, F2, Cl2, Br2 и I2. Эти молекулы имеют характерный запах и обладают ярким цветом. Они являются хорошими окислителями и способны образовывать стабильные анионы.
Галогены имеют отличные физические свойства. Например, фтор является самым легким элементом с наименьшей плотностью и точкой плавления. Хлор и бром находятся в жидком состоянии при комнатной температуре, а йод имеет вид твердого вещества.
Важно отметить, что галогены обладают различной растворимостью в воде. Фтор и хлор хорошо растворяются, бром немного растворяется, а йод практически нерастворим в воде.
Химические свойства галогенов также вызывают интерес. Они реакционны и способны взаимодействовать с другими элементами, образуя различные химические соединения. Галогены широко используются в различных отраслях промышленности и науки.
В периодической системе галогены занимают важное место, так как они являются ключевыми элементами. Их уникальные свойства и высокая химическая активность делают их неотъемлемой частью многих процессов, происходящих в природе и нашей жизни.
Физические свойства галогенов
Во-первых, галогены являются неметаллами. Они характеризуются высокой электроотрицательностью, что делает их отличными окислителями. Кроме того, все галогены – газы или жидкости в нормальных условиях, кроме брома, который представляет собой красный-коричневый жидкий элемент.
Во-вторых, галогены являются очень реактивными элементами. Они обладают высокой активностью в химических реакциях и могут образовывать соединения с большинством других элементов. Галогены также хорошо смешиваются с водой и образуют кислотные соединения.
Также галогены обладают высокой плотностью и температурой кипения. Например, фтор – самый легкий галоген, имеет плотность всего 1,7 г/см³ при комнатной температуре. В то же время, бром – самый тяжелый галоген, его плотность составляет около 3,1 г/см³. Йод и астат представляют собой темно-фиолетовые и черные кристаллы соответственно, которые при нагревании переходят в газообразное состояние.
Наконец, галогены обладают характерным запахом. Например, хлор имеет очень острый запах, похожий на запах отбеливания, а бром – на запах йода. Даже малые концентрации галогенов могут быть заметны человеку благодаря их интенсивному запаху.
В целом, физические свойства галогенов делают их незаменимыми элементами в различных областях науки и промышленности. Благодаря своей реактивности и разнообразию свойств, галогены нашли широкое применение в области производства пластмасс, лекарств, пестицидов, отбеливающих и дезинфицирующих средств, а также в ядерной энергетике и многих других сферах.
Химические свойства галогенов
Первое, что стоит отметить, это то, что все галогены являются очень активными химическими элементами. Они имеют сильную способность к вступлению в химические реакции и образованию химических соединений. Это связано с наличием у галогенов семь электронов во внешней электронной оболочке, что делает их более реактивными по сравнению с другими элементами.
Галогены образуют соединения с большинством других элементов. Они могут образовывать соли и кислоты, а также другие химические соединения. Например, хлор образует хлориды, бром — бромиды, йод — иодиды.
Одно из главных химических свойств галогенов — их окислительные свойства. Галогены обладают способностью окислять другие вещества, передавая электроны. Это делает их уникальными в химических реакциях и позволяет использовать их в различных промышленных и научных процессах.
Еще одной особенностью галогенов является их способность образовывать галогениды с некоторыми элементами, такими как водород. Например, сочетание водорода с фтором образует водород фторид (HF), а с хлором — водород хлорид (HCl). Галогениды также имеют важное применение в различных отраслях науки и промышленности.
Кроме того, галогены могут реагировать с органическими соединениями, что делает их важными для органической химии. Они могут изменять структуру органических молекул путем замены атомов водорода на атомы галогенов. Это позволяет создавать различные химические соединения и продукты, имеющие широкий спектр применений.
В целом, химические свойства галогенов делают их важными и неотъемлемыми элементами в природе и нашей жизни. Они участвуют во многих химических процессах, играют ключевую роль в формировании различных соединений и имеют широкое применение в различных областях науки и промышленности.
Видео:Галогены. 9 класс.Скачать

Ключевая роль галогенов в природе и нашей жизни
Галогены обладают сильными окислительными свойствами и высокой реакционной способностью. Они активно взаимодействуют с другими веществами, образуя соединения различной химической природы.
Одно из основных применений галогенов в природе — это участие в образовании солей. Хлориды, бромиды и йодиды являются основными составными частями многих минералов, почвы и морской воды. Они играют важную роль в водном круговороте и оказывают влияние на физические и биологические процессы в морских экосистемах.
Галогены также широко применяются в различных отраслях промышленности и науки. Фтор используется при производстве специальных видов стекла, а также в составе многих химических соединений, используемых в сталелитейной, электронной и фармацевтической промышленности. Хлор является основным сырьем для производства пластмасс, полимеров и многих химических соединений. Бром применяется в фотоиндустрии, огнезащитных материалах и производстве лекарственных средств. Йод является необходимым микроэлементом для нормального функционирования щитовидной железы у человека и животных.
Кроме того, галогены играют важную роль в медицине. Соединения фтора используются для создания препаратов для профилактики кариеса зубов. Йод содержится в препаратах для лечения ран, ожогов и других поверхностных поражений кожи.
Таким образом, галогены представляют собой неотъемлемую часть химической системы Земли и оказывают значительное влияние на многие аспекты нашей жизни, включая природные процессы, промышленность и медицину.
Видео:9 класс. Галогены. Химические свойства.Скачать
Галогены в природе
Фтор является самым химически активным элементом из всех галогенов. Он образует соединения с широким спектром других веществ, включая металлы, и широко используется в промышленности и медицине.
Хлор также является важным элементом в природе. Он является неотъемлемой частью соли, которая можно найти в морской воде и в многих других природных источниках. Хлор широко используется в производстве химических веществ, пластмасс и других продуктов.
Бром обнаруживается в природе в виде солей, особенно в морских водах и в местах, где происходят вулканические извержения. Он используется в производстве огнезащитных материалов, фотопластинок и других продуктов.
Йод является неотъемлемым компонентом щитовидной железы, органа, который играет важную роль в регуляции обмена веществ в организме. В природе йод обнаруживается в морских водах и почве, а также в некоторых продуктах (например, морской капусте).
Астат – это самый редкий и наименее изученный из всех галогенов. Его можно найти только в следовых количествах в природе.
Галогены в природе играют важные роли в различных процессах. Они влияют на погоду, экологию и жизнь многих организмов. Также галогены широко используются в разных отраслях промышленности, медицине и научных исследованиях.
Натуральные источники галогенов
Галогены, такие как фтор, хлор, бром и йод, встречаются в природе в различных формах и соединениях. Они могут быть найдены в различных природных объектах, включая воду, воздух, почву и растения.
Один из натуральных источников галогенов — морская вода. Она содержит большое количество хлора и йода. Хлор в морской воде присутствует в виде хлоридов, таких как натрий хлорид (NaCl) или поваренная соль. Йод находится в океане в виде йодидов, которые впоследствии могут быть использованы в производстве лекарственных препаратов.
Растения также могут быть натуральными источниками галогенов. Они могут поглощать галогены из почвы и воды и накапливать их в своих органах. Бром, например, может быть обнаружен в некоторых водных растениях, таких как ракитник, а йод встречается в морских водорослях.
Кроме того, галогены могут быть найдены в некоторых рудных и полезных ископаемых. Фтор, например, может быть извлечен из минерала флюорита, а йод — из минерала калиевого йодида. Эти ископаемые широко используются в промышленности для производства различных химических соединений и продуктов.
Натуральные источники галогенов играют важную роль в нашей жизни, так как они широко применяются в различных отраслях, включая пищевую, медицинскую и промышленную. Научно-технический прогресс и развитие экологически чистых процессов производства позволяют эффективно использовать эти элементы и их соединения во благо человечества.
🎬 Видео
ГАЛОГЕНЫ | Химия 9 классСкачать

Галогены VIIA группа | Химия ЕГЭ, ЦТСкачать

ВСЯ ХИМИЯ ЭЛЕМЕНТОВ С НУЛЯ | Химия ЕГЭ 2023 | УмскулСкачать

Водород и галогены | Химия с Юлией ВишневскойСкачать

Галогены.Элементы VII А группы.Скачать

Химия - просто. Урок 1 "ПСЭ"Скачать

Углерод - Самый СТРАННЫЙ химический Элемент!Скачать

ВАЛЕНТНОСТЬ 8 КЛАСС ХИМИЯ // Урок Химии 8 класс: Валентность Химических ЭлементовСкачать

Галогены. Химические свойства | ХимияСкачать

Галогены. Химические свойства простых веществ. Получение.Скачать

Химия 9 класс — Как определять Степень Окисления?Скачать

Химические свойства галогенов | ХимияСкачать

Химия 8 Галогены – элементы и простые веществаСкачать

ГАЛОГЕНЫ. Секреты 7 группы элементов таблицы. [ChemistryToday]Скачать
![ГАЛОГЕНЫ. Секреты 7 группы элементов таблицы. [ChemistryToday]](https://i.ytimg.com/vi/W0qbSfHOHGI/0.jpg)
Галогены (F, Cl, Br, I). Химические свойстваСкачать
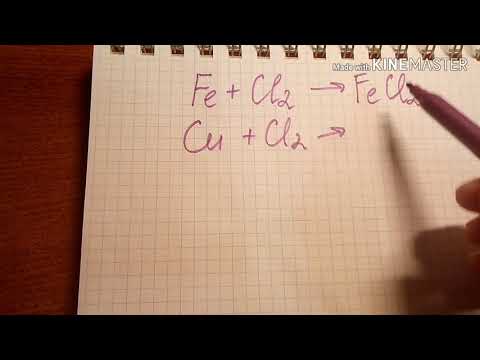
Галлий - металл, который плавится в руке.Скачать
