Электронная плотность — это физическая характеристика, которая определяет вероятность нахождения электронов в определенной области пространства. Она описывает распределение электронов в молекулах и атомах и является ключевым понятием в квантовой химии.
В атоме электронная плотность показывает вероятность нахождения электрона в определенном объеме, называемом орбиталью. Орбитали имеют различную форму и энергию, и они заполняются электронами в соответствии с принципом Паули и принципом Максвелла. Принцип Паули гласит, что каждая орбиталь может содержать максимум два электрона с противоположными спинами.
В молекуле распределение электронной плотности определяет свойства химической связи. Электроны могут существовать в области между атомами, образуя связывающую электронную плотность, или находиться в области вокруг атомов, образуя несвязывающую электронную плотность или плотность валентной оболочки. Взаимодействие этих плотностей влияет на длину и силу химической связи, а также на свойства молекулы в целом.
- Электронная плотность: определение и принципы распределения электронов
- Определение электронной плотности
- Что такое электронная плотность
- Формальное определение электронной плотности
- Значение электронной плотности в химии
- Принципы распределения электронов в молекулах и атомах
- Главные принципы распределения электронов
- Метод Хартри-Фока и распределение электронов
- 📽️ Видео
Видео:Электронные эффекты заместителейСкачать

Электронная плотность: определение и принципы распределения электронов
Определение электронной плотности состоит в том, что электроны в молекулах и атомах не находятся в фиксированных орбиталях, как это было предположено в модели Резерфорда-Бора, а существуют в областях пространства, называемых орбиталями, которые описывают вероятность нахождения электронов вокруг ядра атома или в пространстве между атомами молекулы.
Значение электронной плотности в химии заключается в том, что она позволяет определить, как электроны распределены вокруг атома или молекулы, и как эта распределенная электронная плотность влияет на химические свойства и реакции вещества.
Главные принципы распределения электронов определяются набором правил и моделей, таких как модель слоя Коши-Фока и метод Хартри-Фока. Эти принципы учитывают взаимодействие электронов друг с другом и с ядрами атомов, чтобы определить устойчивое распределение электронной плотности в молекуле или атоме.
Метод Хартри-Фока является одним из наиболее распространенных методов для расчета электронной плотности и связан с решением уравнений Шредингера для системы электронов в молекуле или атоме. Этот метод позволяет получить численное приближенное значения для электронной плотности на различных орбиталях и использовать их для определения различных химических свойств вещества.
Видео:Движение электронов в атоме. 1 часть. 8 класс.Скачать

Определение электронной плотности
Формально электронная плотность определяется как интегральная величина, равная вероятности нахождения электрона в единице объема возле заданной точки пространства. В квантовой механике она рассматривается как квадрат модуля волновой функции, которая описывает состояние электрона и его распределение в пространстве.
Значение электронной плотности в химии тесно связано с такими понятиями, как электронные облака, связи между атомами и электронное строение молекулы. Распределение электронов в молекулах и атомах регулируется принципами, которые определяют возможные конфигурации электронных облаков и их энергетические уровни.
Одним из основных методов для определения электронной плотности является метод Хартри-Фока, который основывается на приближенном решении уравнения Шредингера и позволяет расчитать электронную плотность и энергию системы. С помощью этого метода можно получить информацию о распределении электронов и их взаимодействии в молекуле или атоме.
Что такое электронная плотность
Формально электронная плотность определяется как вероятность обнаружения электрона в единичном объеме пространства. Она измеряется в единицах объемной плотности заряда и представляет собой распределение электронов вокруг атомного ядра или в молекуле.
Значение электронной плотности в химии невероятно важно. Она помогает определить химические свойства вещества и его реакционную способность. Электронная плотность влияет на химическую активность молекулы или атома и является основной особенностью ее строения.
Главные принципы распределения электронов в молекулах и атомах определяются методом Хартри-Фока. Этот метод позволяет рассчитать электронную плотность и описать ее распределение вокруг ядра атома или в молекуле. Он основывается на математической теории квантовой механики и учитывает электронное взаимодействие между частицами.
Таким образом, электронная плотность играет важную роль в химии, позволяя понять строение и свойства молекул и атомов. Она помогает нам лучше понять и объяснить химические явления и процессы, а также способствует развитию новых материалов и технологий.
Формальное определение электронной плотности
Формально электронная плотность (D) определяется как отношение количества электронов (n) в данной области пространства (V) к объему этой области:
| Символ | Определение |
|---|---|
| D | Электронная плотность |
| n | Количество электронов |
| V | Область пространства |
Электронная плотность может быть определена для всей молекулы, атома или конкретной области внутри них. Она отражает вероятность нахождения электронов в определенных областях и может быть представлена в виде трехмерных графиков или через плотность распределения электронов в пространстве.
Значение электронной плотности в химии заключается в том, что она позволяет исследовать химическую связь, строение молекулы и ее свойства. Электронная плотность определяет, как электроны распределены между атомами и как они взаимодействуют друг с другом. Это позволяет предсказывать реакционную способность вещества, его химическое поведение и изменение свойств в различных условиях.
Понимание принципов распределения электронов в молекулах и атомах является основой молекулярной и квантовой химии. Оно позволяет описывать строение и свойства химических соединений, создавать новые материалы с желаемыми свойствами и разрабатывать методы синтеза и анализа.
Главные принципы распределения электронов включают принципы Паули, Гейзенберга и Хунда. Принцип Паули гласит, что в одной электронной орбитали может находиться максимум два электрона с противоположными спинами. Принцип Гейзенберга устанавливает ограничения на одновременную точность измерения координат и импульса электрона. Принцип Хунда указывает, что электроны заполняют энергетические уровни по наиболее низким энергиям и с противоположными спинами, прежде чем заполнять более высокие уровни.
Метод Хартри-Фока является основным методом расчета электронной плотности и основан на решении уравнения Шредингера для системы электронов. Он позволяет определить электронную плотность и энергию системы, и используется для предсказания свойств молекул, реакций и спектров.
Значение электронной плотности в химии
Значение электронной плотности в химии заключается в том, что оно позволяет установить распределение электронов в атомах и молекулах, а также предсказать и описать различные химические свойства веществ. Электронная плотность напрямую связана с электронной структурой и химической активностью вещества.
Большая электронная плотность в определенной области пространства указывает на наличие высокой концентрации электронов и может предсказывать высокую химическую активность. Напротив, низкая электронная плотность указывает на отсутствие электронов в определенной области и может свидетельствовать о низкой химической активности.
Путем анализа электронной плотности и ее распределения в атомах и молекулах можно предсказать структуру молекулы, тип химической связи, а также свойства вещества, такие как плотность, теплоемкость и реакционная способность. Это позволяет ученым проводить синтез новых соединений и улучшать свойства уже существующих веществ.
Расчет электронной плотности осуществляется с использованием различных теоретических и экспериментальных методов, включая метод Хартри-Фока. Эти методы позволяют получить информацию о вероятности нахождения электронов в различных областях пространства и использовать ее для более глубокого понимания химических процессов и взаимодействий.
Видео:БЕЗ ЭТОГО НЕ СДАТЬ ЕГЭ по Химии — Электронная конфигурация атомаСкачать

Принципы распределения электронов в молекулах и атомах
Принципы распределения электронов играют важную роль в химии, поскольку определяют структуру и свойства молекул и атомов. Согласно основным принципам, электроны в атомах и молекулах распределяются в соответствии с принципом наименьшей энергии и правилом заполнения энергетических уровней.
Принцип наименьшей энергии, или принцип главных квантовых чисел, утверждает, что электроны сначала будут заполнять энергетические уровни с меньшей энергией, а затем продвигаться к уровням с более высокой энергией. Это объясняет, почему в атомах сначала заполняются внутренние электронные оболочки, а затем более внешние.
В атомах существуют также правила заполнения энергетических уровней. Различные орбитали (как s, p, d, f) могут содержать разное число электронов. Например, орбиталь s может содержать до 2 электронов, p — до 6 электронов, d — до 10 электронов и f — до 14 электронов. Поэтому при заполнении энергетических уровней, сначала заполняются орбитали с меньшим значением локального квантового числа.
Для молекул также существуют принципы распределения электронов. Электроны молекул могут находиться на разных энергетических уровнях, причем энергетические уровни молекулярных орбиталей формируются из орбиталей атомов, участвующих в молекулярной связи. Принцип наименьшей энергии и правила заполнения электронных орбиталей применяются и в молекулах.
Принципы распределения электронов являются основой для понимания химической связи и химических реакций. Они помогают предсказывать структуру молекул и их свойства, а также объяснять переходы электронов между атомами в процессе реакций. Поэтому понимание этих принципов важно для развития химии и применения ее в различных областях науки и технологии.
Главные принципы распределения электронов
1. Принцип заполнения энергетических уровней: в атоме или молекуле электроны заполняют энергетические уровни, начиная с наиболее низких и двигаясь к наиболее высоким. Этот принцип представляет собой правило, которое гласит, что энергетические уровни должны быть заполнены последовательно в соответствии с их энергией.
2. Принцип Паули: согласно этому принципу, каждый электрон должен иметь уникальные квантовые числа (наборы квантовых чисел), таким образом, в одном атоме или молекуле два электрона не могут иметь одинаковые значения квантовых чисел.
3. Принцип минимизации энергии: система, состоящая из атомов или молекул, стремится к наименьшей энергии. Электроны распределяются таким образом, чтобы осуществить минимальную энергию системы. Это означает, что электроны займут наиболее низкие доступные энергетические состояния.
Главные принципы распределения электронов играют важную роль в определении электронной плотности и структуры атомов и молекул. Знание этих принципов позволяет понять, как электроны организованы вокруг ядра и как формируются химические связи между атомами.
Метод Хартри-Фока является одним из основных подходов к расчету электронных структур молекул и атомов. Он основан на принципе минимизации энергии и позволяет распределить электроны в соответствии с их энергетическими состояниями. Этот метод используется для предсказания молекулярной и атомной структуры, а также для исследования свойств веществ.
Метод Хартри-Фока и распределение электронов
Для определения электронной плотности метод Хартри-Фока использует принцип вариационного итерационного решения уравнения Шредингера, представляющего основную задачу квантовой химии. Этот метод позволяет учесть взаимное влияние электронов и ядер на электронную плотность.
В процессе расчета методом Хартри-Фока электронная плотность на каждой итерации принимается как линейная комбинация базисных функций, которые описывают форму и энергию электронных орбиталей. После достижения сходимости, полученная электронная плотность позволяет рассчитать различные химические характеристики системы, такие как энергия, геометрические параметры, электронная и магнитная структуры и т.д.
| Принципы метода Хартри-Фока: | Применение метода Хартри-Фока: |
|---|---|
| 1. Самосогласованность: в ходе расчета электронная плотность изменяется до достижения сходимости, чтобы учесть взаимодействие электронов и ядер. | 1. Определение энергии связывания в молекулах и атомах. |
| 2. Вариационный принцип: электронная плотность выбирается таким образом, чтобы минимизировать энергию системы. | 2. Расчет электронной структуры для прогнозирования химических свойств веществ. |
| 3. Принцип заполнения: электроны заполняют электронные орбитали в соответствии с принципом Паули и правилами Гунда. | 3. Исследование молекулярных орбиталей и их энергетических уровней. |
Таким образом, метод Хартри-Фока исключительно важен для определения электронной плотности в молекулах и атомах, а также для расчета различных химических характеристик систем. Этот метод является основой для многих современных теоретических исследований в области квантовой химии и квантовой физики.
📽️ Видео
10 класс § 19 "Электронные эффекты в молекулах органических соединений"Скачать

5. Распределение электронов в атомах. Энергетические уровни. Типы орбиталей.Скачать

Метод молекулярных орбиталей. Часть 1. Основные понятия.Скачать
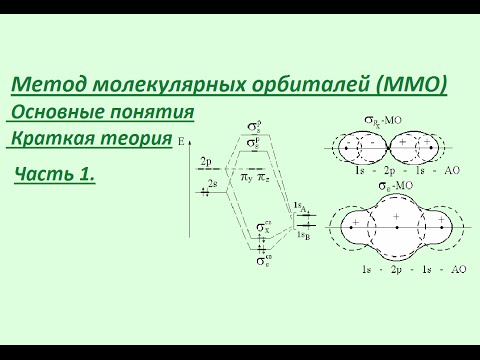
8 Класс. Распределение электронов в атоме | Электронные формулы - ПОЙМЁТ КАЖДЫЙСкачать

Индуктивный и мезомерный эффектыСкачать
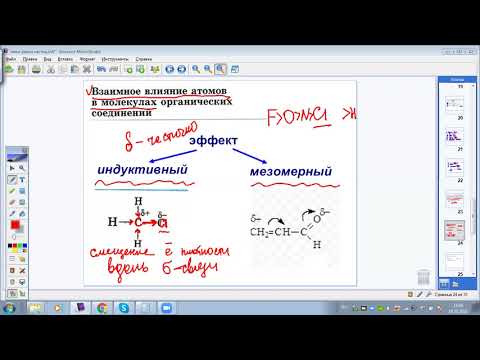
Распределение электронов в атомах. 8 класс.Скачать

Электронные эффектыСкачать

11 класс.Элементы 4 периода.Электронные формулы.Скачать

Химическая связь и взаимное влияние атомов в молекулах. Часть 1.Скачать

Новаковская Ю. В. - Квантовая химия - Распределение электронной плотностиСкачать

Рассмотрение темы: "Взаимодействие молекул"Скачать

Атом:Загадка Электронов. Квантовая механика.Скачать

Урок 11 (осн). Атомы и молекулыСкачать

Измерение электрической проводимостиСкачать

Как распределять электроны по орбиталямСкачать

Электронные формулы d-элементов. Явление проскока электрона.Скачать

Электронные формулы атомов (практика). Учимся составлять электронные формулы атомов.Скачать
