В химии существует множество различных видов химических связей, которые определяют структуру и свойства веществ. Одним из наиболее важных и распространенных видов связи является ковалентная химическая связь.
Ковалентная связь – это тип химической связи, в которой два атома образуют пару электронов, которые они оба используют в образовании связи между собой. Таким образом, оба атома удерживают эти электроны, привлекая их ядрами и деля их между собой. Это делает ковалентную химическую связь очень стабильной и сильной.
Ковалентные связи могут возникать между атомами различных элементов или между атомами одного элемента. В зависимости от того, сколько электронов образует ковалентную связь, она может быть одинарной, двойной или тройной. Ковалентная связь описывается также понятием электронной плотности – вероятности нахождения электронов вокруг атома.
Примером ковалентной химической связи может быть молекула воды, состоящая из двух атомов водорода и одного атома кислорода. Кислород и водород образуют ковалентные связи между собой, обмениваясь электронами. В результате образуется структура, в которой каждый атом окружен семью электронами, общими между соседними атомами. Это делает молекулу воды стабильной и позволяет ей обладать такими химическими свойствами, как растворимость и способность к химическим реакциям.
Видео:Ковалентная Полярная Связь — Химическая связь // Химия 8 классСкачать

Понятие ковалентной химической связи
В ковалентной связи два атома обменивают пару электронов, что позволяет им образовать молекулу. Электроны могут быть общими или принадлежащими только одному атому, но они всегда образуют общую «плотину», которая держит атомы вместе.
При ковалентной связи атомы располагаются близко друг к другу и делят электроны, образуя сильную привязку, которая удерживает их вместе. Ковалентная связь часто встречается в молекулах элементов из группы углерода, азота и кислорода, а также в органических соединениях.
Одним из признаков ковалентной связи является сильная силовая привязка между атомами. Она позволяет молекуле быть стабильной и сохранять свою форму. Ковалентная связь также обладает высокой энергией связи, что делает ее химически стабильной.
Видео:Ковалентная Неполярная Связь — Химическая связь // Химия 8 классСкачать

Определение и признаки ковалентной связи
Основным признаком ковалентной связи является общий подход к электронам: оба атома прикладывают усилия для создания общих электронных пар, чтобы достичь более стабильного состояния. В результате обмена электронами образуется электронная оболочка, состоящая из общих электронов.
Электроны в ковалентной связи проводят большую часть времени около двух атомов, создавая силу притяжения между ними. Это притяжение называется ковалентной связью и является достаточно сильным, чтобы удерживать атомы вместе, но не настолько сильным, чтобы полностью лишить атомы свободы движения.
Основные признаки ковалентной связи:
- Обмен электронами между атомами.
- Образование общих электронных пар.
- Создание ковалентной связи между неметаллами или неметаллом и водородом.
- Образование электронной оболочки с общими электронами.
- Отсутствие полного передачи или потери электронов.
Ковалентная связь играет ключевую роль в органической химии, где она образует основу большинства органических соединений. Эти соединения имеют сложную структуру, которая определяется образованием ковалентных связей между атомами углерода, азота, кислорода и других элементов.
Важность ковалентной связи в органических соединениях заключается в том, что она определяет их химические и физические свойства. Ковалентные связи обеспечивают устойчивость молекул, определяют их форму, определяют активность соединений и их возможность участвовать в химических реакциях.
Электронный обмен и общие электроны
Ковалентная связь через электронный обмен возникает, когда один атом отдает электрон, а другой атом принимает его. Таким образом, оба атома достигают полной валентной оболочки и становятся электронейтральными. В результате обмена электронами образуется электронная пара, которая связывает атомы в молекуле.
Другим способом образования ковалентной связи являются общие электроны. Общие электроны – это электроны, которые находятся на внешней оболочке и доступны для участия в образовании связей. Эти электроны могут быть общими для двух атомов, которые образуют молекулу.
При образовании ковалентной связи через общие электроны, электронная пара обоих атомов образует общую область, где она находится в окрестности обоих ядер. Общая область образуется благодаря перекрытию орбиталей атомов, которые содержат общие электроны.
Таким образом, электронный обмен и общие электроны являются основными принципами образования ковалентной химической связи. Эти механизмы обеспечивают стабильность молекул и организуют упорядоченную структуру вещества.
Способы образования ковалентной связи
Существуют два основных способа образования ковалентной связи:
а) Обмен электронами. В этом случае два атома обмениваются электронами для создания парного электронного облака. Каждый атом вносит по электрону в общий пул, и образуется пара участвующих электронов. Такой обмен электронами позволяет обоим атомам достичь стабильной электронной конфигурации.
б) Общие электроны. В этом случае два атома используют общие электроны для создания электронных облаков вокруг себя. Такие общие электроны обеспечивают стабильность атомов путем образования парных связей.
Способы образования ковалентной связи могут варьироваться в зависимости от типа атомов, их электронной конфигурации и энергетического состояния. Однако в любом случае целью образования ковалентной связи является достижение стабильности и насыщения внешней электронной оболочки атома.
а) Обмен электронами
Процесс обмена электронами осуществляется путем образования пары электронов, каждый из которых принадлежит одновременно обоим атомам. Такая пара электронов называется совместно используемой электронной парой или связывающей парой. В результате обмена электронами между атомами образуется ковалентная связь.
Сильность ковалентной связи определяется тем, насколько сильно энергетически выгодно обменять электроны между атомами. Если атомы имеют разные электроотрицательности, то один атом обладает большей электроотрицательностью и притягивает электроны сильнее, чем другой атом. В результате образуется поляризованная ковалентная связь, где электроны распределены неодинаково между атомами.
Примером обмена электронами может служить образование ковалентной связи между атомами кислорода и водорода при образовании молекулы воды (H2O). Атом кислорода имеет большую электроотрицательность и притягивает электроны от атомов водорода, образуя две связывающие пары электронов. В результате получается ковалентная связь, которая придает молекуле воды устойчивость и определенные химические свойства.
б) Общие электроны
Общие электроны могут принадлежать к одной оболочке или нескольким оболочкам разных атомов. Их наличие позволяет атомам сформировать соединение, при котором электроны распределяются между атомами, образуя ковалентные связи.
Общие электроны играют важную роль в органической химии, так как многие органические соединения содержат атомы углерода, которые образуют ковалентные связи с другими атомами углерода или другими элементами. Общие электроны между атомами углерода и другими элементами обеспечивают стабильность и формируют основу химической структуры органических соединений.
Например, при образовании молекулы метана (CH4), один атом углерода образует ковалентные связи с четырьмя атомами водорода. В этом случае, общие электроны внешней оболочки углерода и водорода образуют четыре пары связывающих электронов, обеспечивая стабильность молекулы.
Таким образом, общие электроны являются ключевым понятием в понимании ковалентной химической связи, особенно в органической химии, и их наличие позволяет атомам образовывать стабильные и химически активные молекулы.
Видео:Ковалентная связь. 8 класс.Скачать
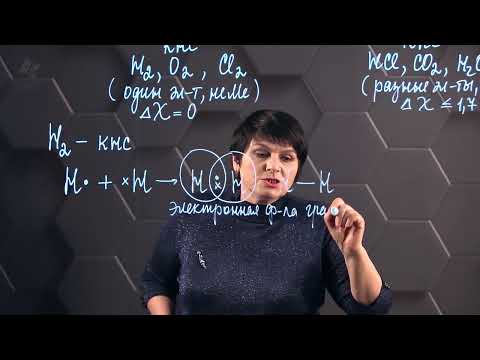
Ковалентные связи в органической химии
В органической химии ковалентные связи играют важную роль в образовании молекул органических соединений. Ковалентная связь образуется между двумя атомами, когда они делят электроны, чтобы достичь устойчивости. Это происходит благодаря тому, что атомы органических соединений имеют неполную электронную оболочку и стремятся к заполнению этой оболочки.
В органической химии ковалентные связи могут быть одинарными, двойными и тройными. Одинарная ковалентная связь образуется при обмене одной пары электронов между атомами. Двойная ковалентная связь образуется при обмене двух пар электронов, а тройная — при обмене трех пар электронов.
Особенностью органических соединений является наличие углерода, который может образовывать ковалентные связи с другими атомами углерода или с атомами других элементов. Ковалентные связи в органической химии обуславливают структуру и свойства органических соединений. Они определяют форму молекулы, ее полярность, а также влияют на химическую активность соединения.
Важность ковалентной связи в органической химии заключается в том, что она обеспечивает устойчивость молекулы и определяет химические свойства соединения. От типа и числа ковалентных связей зависят физические и химические свойства органических соединений, их реакционная способность и возможность взаимодействия с другими веществами.
Важность ковалентной связи в органических соединениях
Ковалентная связь формируется в результате совместного использования электронов внешних оболочек атомов. Атомы распределяют свои электроны таким образом, чтобы достичь наиболее устойчивой конфигурации. Это позволяет им образовывать ковалентные связи и общие электроны.
Важность ковалентной связи в органических соединениях заключается в следующем:
1. Стабильность молекулы: Ковалентная связь удерживает атомы в молекуле вместе, образуя единую структуру. Она предотвращает разрушение молекулы при взаимодействии с другими веществами или внешними факторами, такими как температура или давление.
2. Реакционная активность: Ковалентная связь определяет химическую активность органических соединений. Группы атомов, связанные ковалентной связью, могут подвергаться различным химическим превращениям и реакциям, образуя новые соединения.
3. Функциональность органических соединений: Ковалентная связь позволяет органическим молекулам выполнять свои функции в живых организмах. Молекулы, содержащие ковалентные связи, могут быть основными строительными блоками клеток, участвовать в метаболических процессах и выполнять другие жизненно важные функции.
4. Разнообразие органических соединений: Ковалентная связь обеспечивает огромное разнообразие органических соединений. Взаимодействие атомов различных элементов и структурных элементов молекул позволяет формировать многочисленные классы органических соединений с разными свойствами и функциями.
Таким образом, ковалентная связь является неотъемлемой составляющей органической химии и играет важную роль в обеспечении стабильности, функциональности и разнообразия органических соединений.
🎥 Видео
Химия 8 класс — Ионная Связь // Химическая Связь // Подготовка к ЕГЭ по ХимииСкачать

Ионная, ковалентная и металлическая связи | Химия. ВведениеСкачать

Химия 8 класс (Урок№30 - Ковалентная химическая связь. Полярная и неполярная ковалентная связь.)Скачать

Типы Химических Связей — Как определять Вид Химической Связи? Химия 9 классСкачать

8 класс.Химическая связь.Скачать

Химическая связь. Ковалентная связь | Химия ЕГЭ, ЦТСкачать

Химическая связь. Формулы Льюиса. 8 класс.Скачать

Ковалентная химическая связь | Химия 11 класс #4 | ИнфоурокСкачать

56. Типы химических связей. Ковалентная связьСкачать

Ионная, ковалентная и металлическая связиСкачать

Химия. Химическая связь. Ковалентная связь и ее характеристики. Центр онлайн-обучения «Фоксфорд»Скачать

Химические связи: как их понять без заучивания и для чего это нужно? | Химия ЕГЭ 2022 | УмскулСкачать

57. Механизмы образования ковалентной связиСкачать

Ионная, ковалентная и металлическая связи | Типы химической связиСкачать

Определяем тип химической связиСкачать

8. Виды химической связи.Скачать

Химия 8 класс: Ковалентная химическая связьСкачать
